
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
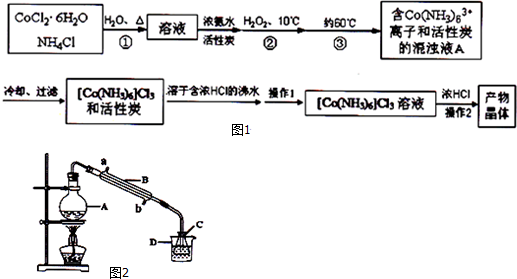
| 温度(℃) | 0 | 20 | 47 |
| 溶解度(g) | 4.26 | 6.96 | 12.74 |
| 指示剂 | 颜色 | 变色的pH范围 | ||
| 甲基红 | 红 | 橙 | 黄 | 4.4~6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
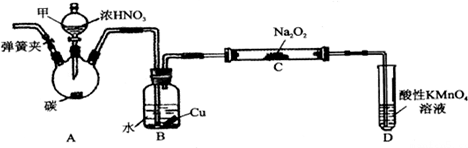
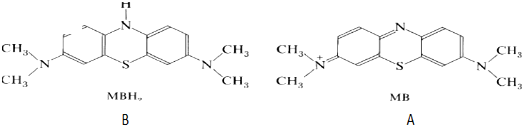
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
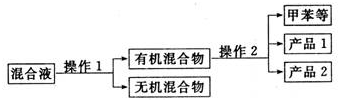
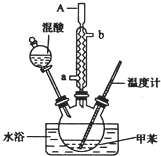 一硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯).反应原理:
一硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯).反应原理:
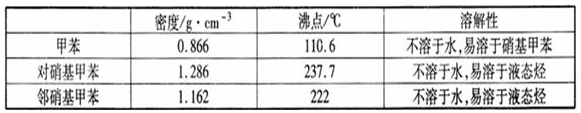
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 一定条件下,向密闭容器中加入1molNO2(g)与1molCO(g)反应放出234kJ热量 | |
| B. | 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 | |
| C. | 若X表示反应时间,则Y表示的可能是混合气体的密度 | |
| D. | 若X表示温度,则Y表示的可能是CO2的物质的量浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com