
分析 (1)根据二价铁易发生水解反应分析;FeSO4溶液变质后生成Fe3+;
(2)步骤3是由溶液中获得晶体,是抑制亚铁离子的水解下的蒸发与结晶过程;
(3)依据该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇分析,洗涤不能溶解产品,不能引入新的杂质.
解答 解:(1)由于FeSO4易发生水解,故加入稀硫酸来抑制其水解;FeSO4溶液变质后生成Fe3+,故取适量FeSO4溶液于试管中,向溶液中加入KSCN溶液,若溶液变红,则说明FeSO4溶液变质,故答案为:抑制FeSO4的水解;取适量FeSO4溶液于试管中,向溶液中加入KSCN溶液,若溶液变红,则说明FeSO4溶液变质,无现象则不变质;
(2)步骤3是由溶液中获得晶体,亚铁离子在加热过程中会发生水解,应在抑制亚铁离子的水解情况下,蒸发浓缩、冷却结晶、过滤、洗涤等.
故答案为:蒸发浓缩、冷却结晶;
(3)因为硫酸亚铁铵易溶于水,不溶于乙醇,应该用乙醇洗涤,减少硫酸亚铁铵的溶解,同时利用乙醇和水互溶,从而达到洗涤的要求,故选d.故答案为:d.
点评 本题考查溶液的加热、过滤、固体溶解、蒸发(防水解)、结晶等一系列实验基本操作、离子检验等,难度不大,是对所学知识的综合运用,注意基础知识的掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
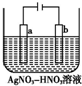 燃料电池是将乙醇通入负极,O2通入正极而发生电池反应的,其能量转换率高.
燃料电池是将乙醇通入负极,O2通入正极而发生电池反应的,其能量转换率高.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
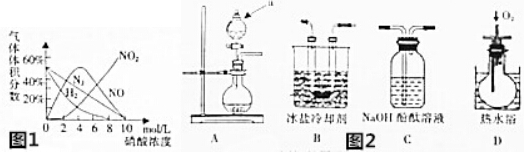
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
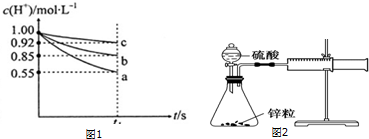
| 序号 | 加入的稀硫酸浓度 | 反应时间/min | 收集的气体/mL | 反应速率mL•min-1 |
| ① | 1mol•L-1 | 11 | 10 | |
| ② | 2mol•L-1 | a | 10 | b |
| ③ | 4mol•L-1 | 10 | 5.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
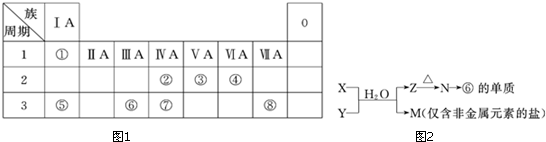
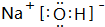 .
.| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 | H2SO3+Br2+2H2O═H2SO3+2HBr |
| 2 | 酸性 | H2SO3+2NaOH═Na2SO3+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
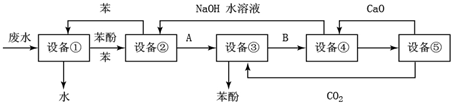 回答下列问题:
回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com