
”¾ĢāÄæ”湤ŅµÉĻÓĆĀĮĶĮæó£ØÖ÷ŅŖ³É·ÖĪŖAl2O3 £¬ »¹ŗ¬ÓŠFe2O3”¢SiO2£©ĢįČ”Ńõ»ÆĀĮ£¬Ņ±Į¶ĀĮµÄŌĮĻ£¬ĢįČ”µÄ²Ł×÷¹ż³ĢČēĶ¼£ŗ
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³ö²½Öč¢ŁÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½£»ĀĖŌü¢ŁµÄ³É·ÖĪŖ £®
£Ø2£©Š“³ö²½Öč¢ŚÖŠÉś³Éŗ¬ĀĮ»ÆŗĻĪļµÄ»Æѧ·½³ĢŹ½£»ÄÜ·ń½«“Ė²½ÖčÖŠµÄNaOH ČÜŅŗøü»»ĪŖ°±Ė®£æ£ØĢī”°ÄÜ”±»ņ”°²»ÄÜ”±£©£®Čō²»ÄÜ£¬ĒėĖµĆ÷ĄķÓÉ£ŗ£ØČōÄÜ£¬Ōņ“ĖæÕ²»“š£©£®
£Ø3£©²½Öč¢ŪÖŠµÄX ĪŖ£ØĢī»ÆѧŹ½£©£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ £®
£Ø4£©ČōĀĮĶĮæóµÄÖŹĮæĪŖmkg£¬×īŗóµĆµ½A12O3µÄÖŹĮæĪŖnkg£ØŗöĀŌĢįČ”¹ż³ĢÖŠĀĮŌŖĖŲµÄĖšŹ§£©£¬ŌņĀĮĶĮæóÖŠĀĮŌŖĖŲµÄÖŹĮæ·ÖŹżĪŖ£ØÓĆŗ¬m”¢n µÄ“śŹżŹ½±ķŹ¾£©£®
”¾“š°ø”æ
£Ø1£©Fe2O3+6H+=2Fe3++3H2O”¢Al2O3+6H+=2Al3++3H2O£»SiO2
£Ø2£©AlCl3+4NaOH=3NaCl+Na[Al£ØOH£©]4»ņAlC13+4NaOH=3NaCl+NaAlO2+2H2O£»²»ÄÜ£»ČōÓĆ°±Ė®£¬Fe3+ÓėAl3+¾ł³Įµķ£¬ĪŽ·Ø½«¶žÕß·ÖĄė
£Ø3£©CO2£»CO2+[Al£ØOH£©4]©=Al£ØOH£©3”ż+HCO3©
£Ø4£©![]()
”¾½āĪö”æ½ā£ŗ£Ø1£©²½Öč¢ŁĪŖAl2O3”¢Fe2O3ÓėĻ”ŃĪĖį·“Ӧɜ³ÉŃĪŗĶĖ®£¬·“Ó¦·½³ĢŹ½ĪŖAl2O3+6H+=2Al3++3H2O”¢Fe2O3+6H+=2Fe3++3H2O£¬SiO2ŗĶĻ”ŃĪĖį²»·“Ó¦£¬Č»ŗó²ÉÓĆ¹żĀĖ·½·ØµĆµ½ĀĖŌü1ĪŖSiO2£»ĖłŅŌ“š°øŹĒ£ŗFe2O3+6H+=2Fe3++3H2O”¢Al2O3+6H+=2Al3++3H2O£»SiO2£»£Ø2£©²½Öč¢ŚĪŖĻņĀĖŅŗ1£ØĀĖŅŗ1ÖŠČÜÖŹÓŠAlCl3”¢FeCl3£©ÖŠ¼ÓČė¹żĮæNaOHČÜŅŗ£¬ĘäÖŠĀČ»ÆĀĮÉś³ÉĘ«ĀĮĖįÄĘ£¬·“Ó¦Īļ¶ī£ŗAlCl3+4NaOH=3NaCl+Na[Al£ØOH£©]4»ņAlC13+4NaOH=3NaCl+NaAlO2+2H2O£»ĀĮĄė×ÓÓė°±Ė®·“Ӧɜ³ÉĒāŃõ»ÆĀĮ³Įµķ£¬ĢśĄė×ÓŅ²³Įµķ£¬ĪŽ·Ø½«ĢśĄė×Ó”¢ĀĮĄė×Ó·ÖĄė£¬¹Ź²»ÄÜÓĆ°±Ė®Ģę“śĒāŃõ»ÆÄĘ£»ĖłŅŌ“š°øŹĒ£ŗAlCl3+4NaOH=3NaCl+Na[Al£ØOH£©]4»ņAlC13+4NaOH=3NaCl+NaAlO2+2H2O£»²»ÄÜ£»ČōÓĆ°±Ė®£¬Fe3+ÓėAl3+¾ł³Įµķ£¬ĪŽ·Ø½«¶žÕß·ÖĄė£»£Ø3£©²½Öč¢ŪĪŖĻņĘ«ĀĮĖįÄĘÖŠ¼ÓČė¹żĮæµÄX×īÖÕµĆµ½ĒāŃõ»ÆĀĮ³Įµķ£¬Ó¦ĪŖ¶žŃõ»ÆĢ¼£¬·“Ó¦ĪŖ£ŗCO2+[Al£ØOH£©4]©=Al£ØOH£©3”ż+HCO3©£»
ĖłŅŌ“š°øŹĒ£ŗCO2£»CO2+[Al£ØOH£©4]©=Al£ØOH£©3”ż+HCO3©£»£Ø4£©µĆµ½A12O3µÄÖŹĮæĪŖnkg£¬ŌņĘäÖŠĀĮŌŖĖŲµÄÖŹĮæĪŖ ![]() kg£¬øł¾ŻĀĮŌŖĖŲÖŹĮæŹŲŗć£¬ŌņŌĀĮĶĮæóÖŠµÄĀĮŌŖĖŲÖŹĮæŅ²ĪŖ
kg£¬øł¾ŻĀĮŌŖĖŲÖŹĮæŹŲŗć£¬ŌņŌĀĮĶĮæóÖŠµÄĀĮŌŖĖŲÖŹĮæŅ²ĪŖ ![]() kg£¬¹ŹĀĮĶĮæóÖŠĀĮŌŖĖŲµÄÖŹĮæ·ÖŹżĪŖ£ŗ
kg£¬¹ŹĀĮĶĮæóÖŠĀĮŌŖĖŲµÄÖŹĮæ·ÖŹżĪŖ£ŗ ![]() £»
£»
ĖłŅŌ“š°øŹĒ£ŗ ![]() £®
£®


 ĒįĖÉæĪĢƵ„ŌŖ²āŹŌAB¾ķĻµĮŠ“š°ø
ĒįĖÉæĪĢƵ„ŌŖ²āŹŌAB¾ķĻµĮŠ“š°ø Š”Ģāæń×öĻµĮŠ“š°ø
Š”Ģāæń×öĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖŠ£¬²»ŹōÓŚ”°³ĒŹŠæÕĘųÖŹĮæČձؔ±±ØµĄµÄĪŪČ¾ĪļŹĒ£Ø £©
A£®¶žŃõ»ÆµŖ B£®¶žŃõ»ÆĢ¼ C£®æÉĪüČėæÅĮ£Īļ D£®¶žŃõ»ÆĮņ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻŌŖĖŲÖÜĘŚ±ķµÄÖŖŹ¶ĶĘ²āŌ×ÓŠņŹżĪŖ115µÄŌŖĖŲ£¬ĻĀĮŠ¶ŌĖüµÄŠšŹöÕżČ·µÄŹĒ £Ø £©
¢ŁĪ»ÓŚµŚ7ÖÜĘŚ ¢Ś·Ē½šŹōŌŖĖŲ ¢Ū×īĶāµē×Ó²ćÓŠ5øöµē×Ó ¢Üƻӊ·ÅÉäŠŌ ¢ŻŹōÓŚµŖ×åŌŖĖŲ ¢ŽŹōÓŚļ¹ĻµŌŖĖŲ
A. ¢Ł¢Ū¢Ż B. ¢Ś¢Ü¢Ž C. ¢Ł¢Ū¢Ž D. ¢Ū¢Ü¢Ż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ25”ꏱ£¬Ļņ100 mLŗ¬ĀČ»ÆĒā14.6 gµÄŃĪĖįČÜŅŗĄļ·ÅČė5.60 g“æĢś·Ū£Ø²»æ¼ĀĒ·“Ó¦Ē°ŗóČÜŅŗĢå»żµÄ±ä»Æ£©£¬·“Ó¦æŖŹ¼ÖĮ2 minÄ©£¬ŹÕ¼Æµ½1.12 L£Ø±ź×¼×“æö£©ĒāĘų”£ŌŚ“ĖÖ®ŗó£¬ÓÖ¾¹ż4 min£¬Ģś·ŪĶźČ«Čܽā”£Ōņ£ŗ
£Ø1£©ŌŚĒ°2 minÄŚÓĆFeCl2±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹŹĒ_____________________”£
£Ø2£©ŌŚŗó4 minÄŚÓĆHCl±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹŹĒ______________________”£
£Ø3£©Ē°2 minÓėŗó4 minĻą±Č£¬·“Ó¦ĖŁĀŹ½ĻæģµÄŹĒ____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĆŗŹĒ”°¹¤ŅµµÄĮøŹ³”±£¬ŹÆÓĶŹĒ”°¹¤ŅµµÄŃŖŅŗ”±”£ÓŠ¹ŲĆŗŗĶŹÆÓĶ¼Ó¹¤µÄĖµ·ØÕżČ·µÄŹĒ
A. ĆŗµÄøÉĮó²śĪļÖ÷ŅŖŹĒø÷ĄąÓŠ»śĪļ
B. ŹÆÓĶµÄĮŃ½ā”¢·ÖĮóŗĶĆŗµÄøÉĮó¶¼ŹōÓŚ»Æѧ±ä»Æ
C. Ćŗ½¹ÓĶ¾¹ż·ÖĮóæɵƵ½±½”¢¼×±½µČ£¬ĖµĆ÷ĆŗÖŠŗ¬ÓŠ±½ŗĶ¼×±½
D. ŹÆÓĶµÄĮŃ»Æ£¬ĖµĆ÷³¤Į“ĢžŌŚøßĪĀĢõ¼žĻĀæÉŅŌ·Ö½āĪŖ¶ĢĮ“Ģž
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æT”ę£¬½«2 mol XŗĶ1 mol Y³äČėĢå»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ£¬ŅŃÖŖ£ŗ2X(g)+Y(g) ![]() 2Z(s)”÷H=-M kJ”¤mol-1”£10 minŗó“ļµ½Ę½ŗā£¬Éś³É0.2 mol Z£¬¹²·Å³öČČĮæN kJ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ ( )
2Z(s)”÷H=-M kJ”¤mol-1”£10 minŗó“ļµ½Ę½ŗā£¬Éś³É0.2 mol Z£¬¹²·Å³öČČĮæN kJ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ ( )
A. ŌŚ10 minŹ±£¬XµÄ·“Ó¦ĖŁĀŹĪŖ0.02 mol”¤L-1”¤min-l
B. ŌŚ0”«10 minÄŚ£¬YµÄ·“Ó¦ĖŁĀŹĪŖ![]() mol”¤L-1”¤min-l
mol”¤L-1”¤min-l
C. ĪŽ·Ø¼ĘĖćøĆĪĀ¶ČĻĀYµÄĘ½ŗā×Ŗ»ÆĀŹ
D. ·“Ó¦“ļĘ½ŗāŗ󣬱£³ÖT”ę£¬ĶØČėĻ”ÓŠĘųĢåŌö¼ÓŃ¹Ē棬Ōņ»Æѧ·“Ó¦ĖŁĀŹ±äæģ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶ØĪĀ¶ČĻĀ£¬ĻņV LĆܱÕČŻĘ÷ÖŠ¼ÓČė1 mol XĘųĢåŗĶ2 mol YĘųĢ壬·¢Éś·“Ó¦£ŗX(g)£«2Y(g)![]() 3Z(g)£¬“Ė·“Ó¦“ļµ½Ę½ŗāµÄ±źÖ¾ŹĒ( )
3Z(g)£¬“Ė·“Ó¦“ļµ½Ę½ŗāµÄ±źÖ¾ŹĒ( )
A. ČŻĘ÷ÄŚĘųĢåĆÜ¶Č²»Ėꏱ¼ä±ä»Æ B. vÕż(X)£½2vÄę(Y)
C. ČŻĘ÷ÄŚX”¢Y”¢ZµÄÅØ¶Č²»Ėꏱ¼ä±ä»Æ D. ČŻĘ÷ÄŚ»ģŗĻĘųĢåµÄŃ¹Ēæ²»Ėꏱ¼ä±ä»Æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗÓŠ»ś»ÆŗĻĪļA”«FµÄĻą»„×Ŗ»Æ¹ŲĻµČēĶ¼£¬DĪŖŹÆÓĶĮŃ½āµÄÖ÷ŅŖ²śĪļÖ®Ņ»£¬DŌŚ±ź×¼×“æöĻĀµÄĆܶČĪŖ1.25 g”¤L-1£¬CÄÜ·¢ÉśŅų¾µ·“Ó¦£¬FĪŖÓŠĻćĪ¶µÄÓĶדŅŗĢ唣

Ēė»Ų“š£ŗ
£Ø1£©ÓŠ»śĪļBÖŠŗ¬ÓŠµÄ¹ŁÄÜĶÅĆū³ĘŹĒ________________
£Ø2£©D”śBµÄ·“Ó¦ĄąŠĶŹĒ______________________
£Ø3£©B£«E”śFµÄ»Æѧ·½³ĢŹ½ŹĒ__________________________________________
£Ø4£©ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ______________”£
a£®ŌŚ¼ÓČČĢõ¼žĻĀ£¬ÓŠ»śĪļAŗĶC¶¼ÄÜŹ¹ŠĀÖĘµÄ¼īŠŌĒāŃõ»ÆĶŠü×ĒŅŗ²śÉś×©ŗģÉ«³Į¶Ø”£
b£®FŌŚ¼īŠŌĢõ¼žĻĀ¼ÓČČĖ®½āŹōÓŚČ”“ś·“Ó¦£¬ÓÖ½ŠŌķ»Æ·“Ó¦”£
c£®DŗĶŃõĘųŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦Ņ²æÉŅŌÖʵĆC»ņE”£
d£®ÓŠ»śĪļBÖŠŹĒ·ń»ģÓŠEæÉÓĆ½šŹōÄĘ½ųŠŠ¼ģ²ā”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij»ÆѧŠĖȤŠ”×éĻė“ÓFeI2ČÜŅŗÖŠ»ńµĆµāµ„ÖŹ£¬ĘäÉč¼ĘĮ÷³ĢČēĶ¼”£
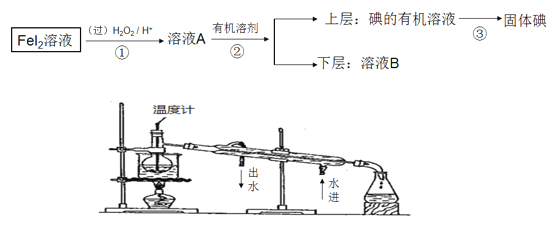
Ēė»Ų“š£ŗ
£Ø1£©²Ł×÷¢ŚÖŠ³żÉÕ±Ķā£¬»¹ŅŖÓƵ½µÄ²£Į§ŅĒĘ÷µÄĆū³ĘŹĒ________________
£Ø2£©ÓŠĶ¬Ń§ŹŌĶ¼ĄūÓĆÕōĮó·½·ØĄ“ŹµĻÖµŚ¢Ū²½²Ł×÷£¬øĆĶ¬Ń§Éč¼ĘĮĖČēĶ¼µÄŹµŃé×°ÖĆ£¬“Ė×°ÖĆÖŠµÄĆ÷ĻŌ“ķĪóŹĒ___________________________________
£Ø3£©ČÜŅŗB³Ź»ĘÉ«£¬³żĮĖŗ¬Fe3+£¬æÉÄÜ»¹ŗ¬ÓŠI2£¬ĒėÄćÉč¼ĘŅ»øöŹµŃé·½°ø¼ÓŅŌÖ¤Ć÷£¬ÄćµÄŹµŃé²Ł×÷·½°øŹĒ__________________________________________
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com