
根据表中信息,判断下列叙述中正确的是
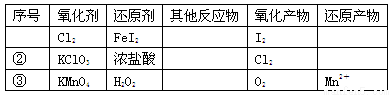
A.表中①组的反应中氧化产物一定是I2
B.氧化性强弱的比较:KClO3>Cl2>Fe3+>I2
C.表中②组每生成1molCl2,转移1mol电子
D.表中③组其他反应物可以为浓盐酸
B
【解析】
试题分析:A、碘离子的还原性强于亚铁离子,氯气首先氧化碘离子,然后氧化亚铁离子,所以其氧化产物也可能含有铁离子,A错误;B、氯酸钾能把浓盐酸氧化生成氯气,氯气能氧化亚铁离子为铁离子,铁离子能氧化碘离子为单质碘,所以氧化性强弱顺序为KClO3>Cl2>Fe3+>I2,B正确;C、氯酸钾氧化浓盐酸的方程式为KClO3+6HCl=KCl+3Cl2↑,其中氧化剂氯酸钾与还原剂氯化氢的物质的量之比是1:5,所以每生成1molCl2,转移5/3mol电子,C错误;D、酸性高锰酸钾溶液能氧化浓盐酸,所以不能用浓盐酸酸化高锰酸钾溶液,应该用稀硫酸,D错误,答案选B。
考点:考查氧化还原反应的有关应用


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届山东省高三上学期第一次(10月)检测化学试卷(解析版) 题型:选择题
卫生部发出公告,自2012年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是 ( )
A.CaO2具有氧化性,对面粉可能具有增白作用
B.CaO2中阴阳离子的个数比为1∶1
C.CaO2与水反应时,每产生1 mol O2转移电子4 mol
D.CaO2与CO2反应的化学方程式为2CaO2+2CO2===2CaCO3+O2
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
下图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是( )

选项 | X | Y |
A. | MgSO4 | CuSO4 |
B. | AgNO3 | Pb(NO3)2 |
C. | FeSO4 | Al2 (SO4)3 |
D. | CuSO4 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:填空题
(16分)化学学习中要注重对过程的分析,按要求回答下列问题:
(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液到中性,写出发生反应的离子方程式____;在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式________。
(2)将一小块钠投入到盛氯化铵的溶液中,有氨气生成,其反应过程分为两步,其中第二步反应的离子方程式为__________。
(3)过氧化钠与干燥的二氧化碳不反应,与湿润的二氧化碳反应生成氧气,则该过程的两个反应方程式分别为___________________、__________________。
(4)向石蕊试剂中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是__________、_________。
(5)向含1molFeBr2的溶液中通入______L(标准状况下)氯气,才能将Fe2+全部转化为Fe3+。(6)足量的铜与一定体积的浓硫酸反应,反应后溶液中所含的溶质有______(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:选择题
化学与生活密切相关,下列说法错误的是
A.航天服材质是由碳化硅/陶瓷和碳纤维等复合而成,具有耐高温防寒等性能
B.从海水提取物质不一定都必须通过化学反应才能实现
C.二氧化硅可用于制备太阳能电池板,晶体硅可用于制作光导纤维
D.明矾可用于自来水的净化,氯气可用于自来水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(A卷)(解析版) 题型:选择题
下列关于Fe2(SO4)3的叙述正确的是(设NA为阿伏加德罗常数的数值)
A.1mol/L的 Fe2(SO4)3溶液中含有2NA个Fe3+(不考虑水解)
B.1mol的 Fe2(SO4)3和S2-反应可转移2NA个电子
C.在该溶液中,K+、NH4+、I-、SO42-可以大量共存
D.与Cu反应的离子方程式为:Fe3++Cu = Fe2+ + Cu2+
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三10月月考化学试卷(解析版) 题型:填空题
(8分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;7在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:________________________ 。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三11月阶段模块考试化学试卷(解析版) 题型:实验题
(11分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
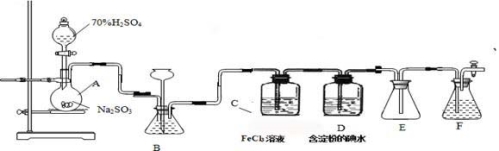
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置E的作用是 。装置F中为 溶液。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)SO2气体还原Fe3+反应的产物是________________(填离子符号)。
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____ ,原因是_______________________________________。
(5)能表明I-的还原性弱于SO2的现象是__________________________,
写出有关离子方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com