
| AgCl | AgI | Ag2S | |
| Ksp | 1.8��10-10 | 8.51��10-16 | 6.3��10-50 |
| A������ת����ʵ�ʾ��dz����ܽ�ƽ����ƶ� |
| B���ܽ��С�ij�������ת��Ϊ�ܽ�ȸ�С�ij��� |
| C��AgCl�����ڵ����ʵ���Ũ�ȵ�NaCl��CaCl2��Һ�е��ܽ�̶���ͬ |
| D��25��ʱ���ڱ���AgCl��AgI��Ag2S��Һ�У�����Ag+��Ũ�Ȳ�ͬ |
| 1.8��10-10 |
| 8.51��10-16 |
| 3 | 6.3��10-50 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��+262.6 kJ?mol-1 |
| B��-131.3 kJ?mol-1 |
| C��-352.3 kJ?mol-1 |
| D��+131.3 kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| Ũ��/mol?L-1 | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
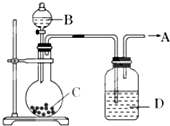 Ϊ����ȡ�������������A��������ͼ��ʾװ�ã�����A���ٶȿ�ͨ������Һ��B���ٶȿ��ƣ���֪A��һ����ɫ����ζ������ʹ���ָʾ����ɫ�������ڿ�����ȼ�յ����壬����ʹ�����ǵ�ľ����ȼ��
Ϊ����ȡ�������������A��������ͼ��ʾװ�ã�����A���ٶȿ�ͨ������Һ��B���ٶȿ��ƣ���֪A��һ����ɫ����ζ������ʹ���ָʾ����ɫ�������ڿ�����ȼ�յ����壬����ʹ�����ǵ�ľ����ȼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com