
【题目】A、B、C、D四种物质之间有下图所示的转化关系。
已知:A是气体单质,C 是红棕色气体。

回答下列问题:
(1)写出C的化学式:________;
(2)在上图D→B的过程中,D表现出强_____(填“氧化性”或“还原性”);
(3)写出C→D转化的化学方程式__________________________________
(4)D→B的离子方程式_____________________________________________
(5)C 是红棕色气体,若A是气态氢化物,则A的电子式为___________
【答案】NO2 氧化性 ![]()
![]()
![]()
【解析】
在中学阶段,我们学习的红棕色气体只有NO2。此气体为解题的突破口。
由流程图可推出单质A为N2,B为NO,C为NO2,D为HNO3。
(1)C的化学式:NO2。答案为:NO2
(2)在上图HNO3→NO的过程中,HNO3中的N元素由+5价降低为+2价,表现出强氧化性。答案为:强氧化性
(3)NO2→HNO3转化的化学方程式3NO2+H2O==2HNO3+NO
答案为:3NO2+H2O==2HNO3+NO
(4)HNO3→NO的离子方程式3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O
答案为:3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O
(5)C 是红棕色气体,若A是气态氢化物,则A为NH3,它的电子式为![]()
答案为![]()


科目:高中化学 来源: 题型:
【题目】向盛有5 mL 0.01 mol/L的硫氰化钾溶液的小烧杯中,加入5 mL0.01 mol/L的FeCl3溶液,混合液立即__________。写出上述反应的离子方程式_____________。向以上溶液中再加0.1 mol/L NaOH溶液至过量,其现象是__________,写出发生上述现象的反应离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
(1)现有以下仪器和用品:橡胶管、秒表、温度计、amol/L稀硝酸、bmol/L稀硝酸及下图中仪器.
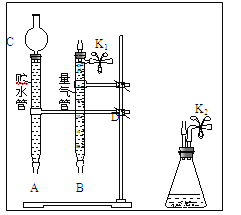
①写出本实验的化学方程式,并标出电子转方向和数目:__________________________.
②设计实验方案:在_________________下,测定________________________________.
③在答卷的图中将A、B、C、D、几处用橡胶管以正确方式连接起来,以测定反应所产生气体的体积(三个容器中的液体和水都已画出)_______________.
④测定前,为避免NO被氧化为NO2,要用CO2排出锥形瓶和橡胶管中的空气:在锥形瓶中加入铜片后松开K2弹簧夹,从K2处的橡胶管向装置中通入CO2,此时K1处应进行的操作是____________,则空气已排尽.
(2)注入稀硝酸后,在给定条件下设计实验探究浓度和温度对化学反应速率的影响:温度25℃、50℃;时间t1、t2、t3;收集气体体积V1、V2.请完成下表:____________
实验 | 稀硝酸的浓度/(mol/L) | 稀硝酸的体积/mL | 温度 | 时间 | 收集气体 |
① | a | V | 25 | t1 | V1 |
② | V | ||||
③ | V |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是![]()
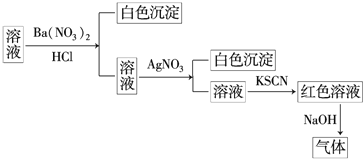
A.原溶液中一定含有![]() B.原溶液中一定含有
B.原溶液中一定含有![]()
C.原溶液中一定含有![]() D.原溶液中一定含有
D.原溶液中一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.配制250mL0.5mol/L的NaOH溶液,所需的仪器有烧杯、玻璃棒、托盘天平、胶头滴管和_______。定容时俯视观察刻度线,其结果_______。(填“偏大”、“偏小”、或“不变”)
Ⅱ.实验室用加热固体氯化铵和氢氧化钙的混合物制取氨气,反应的化学方程式是_______;所制得的气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出合适选择,并将对应选择的装置编号字母填入表中的空格处:
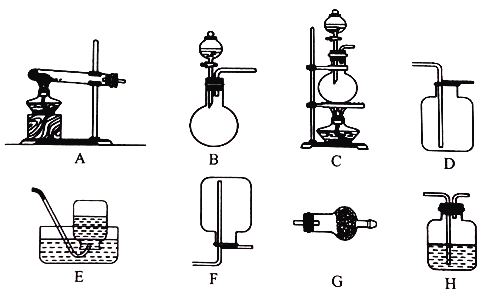
试剂:a. NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰
f.品红溶液 g.湿润的红色石蕊试纸
制取气体 | 杂质气体 | 制取气体的 发生装置 | 收集装置 | 净化装置中 所用的试剂 | 检验制得的气体 所用试剂 |
NH3 | H2O(g) | _______ | F | e | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X中含有右表离子中的某5种,且其浓度均为![]() 不考虑水的电离与离子水解
不考虑水的电离与离子水解![]() 向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
阳离子 | 阴离子 |
Fe Fe |
|
A.X溶液中不可能含有![]() 或
或![]()
B.生成无色气体的离子方程式为:![]()
C.根据电荷守恒,原溶液中一定含![]()
D.X溶液中一定含3种阳离子、2种阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
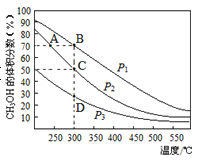
A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿挥发油是青蒿的活性成分(几乎不溶于水,可溶于乙醚,熔点156-157℃,对热不稳定,乙醚的沸点34.6℃),有抗菌、解热、止咳等作用。实验室从青蒿中提取青蒿挥发油的流程如图所示。
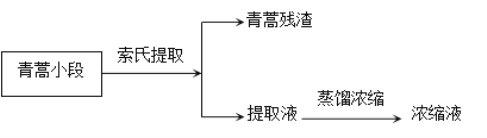
索氏提取装置如图所示,实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与青蒿小段接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对青蒿小段的连续萃取。回答下列问题:

(1)实验时需将青蒿剪成1-2cm小段,放入滤纸套筒1中,剪成小段的目的是___,圆底烧瓶中加入乙醚为溶剂时,应不超过烧瓶容积的___。
(2)索氏提取器中滤纸套筒的高度(x)、套管内青蒿小段的高度(y)及虹吸管的高度(z)由大到小的顺序是___(用x、y、z回答),与常规的萃取相比,采用索氏提取器的优点是___。
(3)提取时球形冷凝管中冷水应从__(填“a”或“b”)管导入,提取液需经___(“常压”或“减压”)蒸馏法除去大部分溶剂,下列仪器在该蒸馏中需要用到的有___(填字母标号)。
A.直形冷凝管 B.球形冷凝管 C.锥形瓶 D.烧杯 E.温度计
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g) +2H2(g) ![]() CH3OH(g) △H =-90.8 kJ·mol-1
CH3OH(g) △H =-90.8 kJ·mol-1
300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 molCO、2 mol H2 | 1mol CH3OH | 2mol CH3OH | |
平衡 时 数据 | CH3OH的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | a kJ | bkJ | ckJ | |
体系压强(Pa) | p1 | p2 | p3 | |
反应物转化率 | a1 | a2 | a3 | |
下列说法正确的是
A. 2c1>c3 B. ∣a∣+∣b∣=90.8
C. 2p2<p3 D. a1+ a3<1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com