
【题目】A、B、C、D、E、F是原子序数依次增大的同周期元素,已知A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的次外层电子数比最外层电子数多4个,E元素原子最外层与最内层电子数的差是3,试回答:
(1)写出下列元素的元素符号:A _____ C _____ D ____ _ E _____ 。
(2)用电子式表示B和F形成化合物的过程:_____ 。
(3)D在周期表中的位置_____ ,E的氢化物中化学键类型是 ,比较D与E氢化物的稳定性 (用化学式填空);
(4)写出C、F两种元素最高价氧化物的水化物相互反应的化学方程式: ___ _____
【答案】(1) Na Al Si P(2)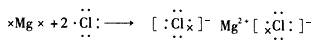
(3)第三周期ⅣA族 极性共价键 PH3>SiH4(4)Al(OH)3+3HClO4=Al(ClO4)3+3H2O
【解析】试题分析:D元素原子的次外层电子数比最外层电子数多4个,则D是硅元素,E元素原子最外层与最内层电子数的差是3,则E是磷元素;A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,说明C一定是铝元素,由于A、B、C、D、E、F是原子序数依次增大的同周期元素,则A是钠元素,F是氯元素;B是镁元素;
(1)A 、C 、D 、E的元素符号分别为Na、Al、Si、P;
(2)用电子式表示B和F形成化合物的过程: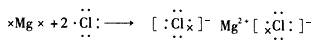 ;
;
(3)D是硅元素,在周期表中的位置是第三周期ⅣA族,E的氢化物是PH3,化学键类型是极性共价键;非金属性P>Si,则D与E氢化物的稳定性为PH3>SiH4;
(4)C、F两种元素最高价氧化物的水化物分别为Al(OH)3、HClO4,反应的化学方程式为Al(OH)3+3HClO4=Al(ClO4)3+3H2O。


科目:高中化学 来源: 题型:
【题目】硝酸铝[Al(NO3)3]是一种常用媒染剂。工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)39H2O]的流程如图甲:
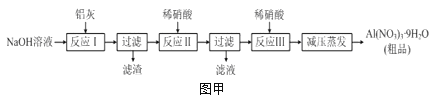
(1)写出反应Ⅰ的离子方程式:______________________________________________。
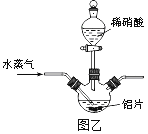
(2)若用图乙所示实验装置制取Al(NO3)3,通入水蒸气的作用是__________________。
(3)上述流程中采用减压蒸发,并控制反应Ⅲ中加入的稀硝酸稍过量,其目的是__________。
(4)温度高于200℃时,硝酸铝完全分解成氧化铝和某气体。已知:2NO2+2NaOH=NaNO2+NaNO3。为了确定生成气体的成分,某学生拟用下列装置进行实验。
①进行实验时装置接口正确顺序是A→________________________→F。
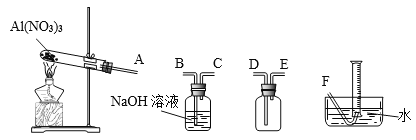
②证明分解生成的混合气体中有NO2的现象是_____________________。
③取21.3g Al(NO3)3加热分解,用排水法收集气体,最终在标准状况下收集到_____mL气体,结合化学方程式说明理由____________________________。
(5)设计实验证明粗品中含有Al(NO3)3:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物是化学与工业中运用广泛的物质。

(1)该小组利用电解原理设计了如右图装置进行H2还原NO的实验(高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极)。铂电极B是____极,钯电极A的电极反应式为_____________。
(2)若工业废水中的NO2- 的浓度约为1.0×10-4 mol·L-1 ,取工业废水5 mL 于试管中,滴加2滴0.1 mol·L-1 的硝酸银溶液,能否看到沉淀现象?试通过计算说明。(注:1mL溶液以20滴计;Ksp(AgNO2)=2×10-8)
(3)已知键能数据,H-H 436,S=S 255,H-S 339,单位kJ/mol。请计算热化学方程式2H2(g) + S2(g) = 2H2S(g)的ΔH=___________
(4)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
根据表中数据,列式计算25.0℃时的分解平衡常数:__________________________。
已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。

根据图中信息,如何说明水解反应速率随温度升高而增大:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为浓硫酸与铜片反应的装置。请回答:
(1)浓硫酸与铜片反应的化学方程式为 。

(2)反应一段时间后,试管乙中品红溶液的现象是 。
(3)下列有关该实验的说法中,不正确的是 。
A.该反应中浓硫酸只体现酸性
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染
C.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯,溶液显蓝色
D.含0.04mol溶质的浓硫酸与足量的铜片反应,能收集到448mL的SO2(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、T、U五种短周期元素。X、Y、Z三元素在周期表中的位置如下所示,三元素的原子序数之和是41。X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物。U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红。
X | |
Y | Z |
(1)各元素的符号是:Z________,T________
(2)Y原子的结构示意图为____________________,U2X的电子式
(3)YX2和U2Y反应的化学方程式为____________________________,其中氧化剂是____________,被氧化的元素是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近来, 科学家研制了一种新型的乙醇电池(DEFC), 它用磺酸类质子作溶剂, 在200℃左右时供电, 乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为: C2H5OH+3O2 ![]() 2CO2+3H2O。下列说法不正确的是
2CO2+3H2O。下列说法不正确的是
A.C2H5OH在电池的负极上参加反应 B.1 mol乙醇被氧化转移6 mol电子
C.在外电路中电子由负极沿导线流向正极 D.电池正极得电子的物质是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是清洁的能源,也是重要的化工原料,根据以下两种制氢方法。完成下列问题:
(1)方法一:H2S热分解法,反应式为:2H2S(g)![]() 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见右图,图中曲线a表示H2S的平衡转化率与温度关系,曲线表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。

①△H______0,(“>”、“<”或“=”),
②若985℃时,反应经tmin达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=______(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:______。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.相关主要反应如下:
I:C(s)+H2O(g)═CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g) △H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)═CaCO3(s) △H=-178.3kJ/mol
①计算反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=______;
CaCO3(s)+2H2(g)的△H=______;
若K1、K2、K3分别为反应I、Ⅱ、Ⅲ的平衡常数,该平衡常数K=_____________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是______。(填字母编号)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是______。(填字母编号)
A.降低体系的温度
B.压缩容器的体积
C.适当增加水蒸气的通入量
D.增加CaO的量
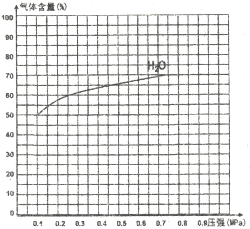
③下图为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图。若反应达某一平衡状态时,测得c(H2O)=2c(H2)=2c(CO)=2mol/L,试根据H2O的体积百分含量变化曲线,补充完整CO的变化曲线示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修2 化学与技术】
Ⅰ.下列有关叙述正确的是( )
A.碱性锌锰电池中,MnO2是催化剂
B.银锌纽扣电池工作时,Ag2O被还原为Ag
C.放电时,铅酸蓄电池中硫酸浓度不断增大
D.电镀时,待镀的金属制品表面发生还原反应
Ⅱ.锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为 。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的 操作。
(3)浸出液“净化”过程中加入的主要物质为 ,其作用是 。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气是 。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生主要反应的离子方程式为 。
(6)我国古代曾采用“火法”工艺冶炼锌,明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为 。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiCIO4。溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。

回答下列问题:
(1)外电路的电流方向是由____极流向____极。(填字母)
(2)电池正极反应式为__ __。
(3)是否可用水代替电池中的混合有机溶剂?____(填“是”或“否”),原因是_________ ___。
(4)MnO2可与KOH和KClO3,在高温下反应,生成K2MnO4,反应的化学方程式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com