
����Ŀ��һ���¶��������Ϊ5L���ܱ������з���ij���淴Ӧ���仯ѧƽ�ⳣ������ʽΪ��K=![]() ��
��
��1����д���÷�Ӧ�Ļ�ѧ����ʽ��___��
��2�����º��������������������ƽ����Է�������������ķ����������������___������ʱ��仯������˵���÷�Ӧ�Ѵ�ƽ��״̬��
��3���÷�Ӧ���淴Ӧ������ʱ��仯�Ĺ�ϵ��ͼ��t1ʱ��ͻ��һ������Ϊij�������ĸı䣬�øı䲻������___��
a����СH2Ũ�� b��ʹ�ô��� c�������¶�
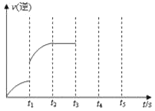
���𰸡�C(s)+H2O(g)CO(g)+H2(g) ѹǿ���ܶ� ab
��������
��1�����ݻ�ѧƽ�ⳣ������ʽ֪����������CO����������Ӧ����ˮ������Ԫ���غ�֪����Ӧ�ﻹ����C��
��2�����淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ��������ʵ���Ũ�ȡ��ٷֺ����Լ��ɴ������һϵ�����������䣻
��3���ı�����ʱ�淴Ӧ�����������ŷ�Ӧ�Ľ��У��淴Ӧ����������˵��ƽ�������ƶ����ݴ˽��
��1�����ݻ�ѧƽ�ⳣ������ʽ֪����������CO����������Ӧ����ˮ������Ԫ���غ�֪����Ӧ�ﻹ����C�����Ըÿ��淴ӦΪC(s)+H2O(g)CO(g)+H2(g)��
�ʴ�Ϊ��C(s)+H2O(g)CO(g)+H2(g)��
��2���÷�Ӧǰ�����������֮���������Ժ��º��������������������ƽ����Է�������������ķ����������������ѹǿ���ܶȶ��ı䣬����Щ��������ʱ��仯ʱ�÷�Ӧ�ﵽƽ��״̬��
�ʴ�Ϊ��ѹǿ���ܶȣ�
��3���ı�����ʱ�淴Ӧ����ͻȻ�������ŷ�Ӧ�Ľ��У��淴Ӧ���ʼ�������˵��ƽ�������ƶ���
a����СH2Ũ�ȣ��淴Ӧ���ʼ�С���˸ı䲻���ܣ�a����ȷ��
b��ʹ�ô������淴Ӧ����������ƽ�ⲻ�ƶ����˸ı䲻���ܣ�b����ȷ��
c��̼��ˮ�����ķ�Ӧ�������ȷ�Ӧ�������¶ȣ������ƶ������淴Ӧ���ʶ����˸ı���ܣ�c�����
�ʴ�Ϊ��ab��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����(����)
A. ����ϡ���ᷴӦ��2Fe+6H��=2Fe3��+3H2��
B. ������������Һ���չ���������̼���壺CO2 +OH��=HCO3��
C. �Ʊ������������壺Fe3++3OH��-Fe(OH)3��
D. �����ȥˮ����2H+ +CaCO3=Ca2++CO2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����ڿ��淴ӦX(g)��3Y(g)![]() 2Z(g)����X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3(����Ϊ��)���ﵽƽ��ʱ��X��Y��Z��Ũ�ȷֱ�Ϊ0.1mol��L-1��0.3mol��L-1��0.08mol��L-1���������ж���ȷ���ǣ� ��
2Z(g)����X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3(����Ϊ��)���ﵽƽ��ʱ��X��Y��Z��Ũ�ȷֱ�Ϊ0.1mol��L-1��0.3mol��L-1��0.08mol��L-1���������ж���ȷ���ǣ� ��
A. c1��c2��3��1
B. X��Y��ת���ʲ����
C. ƽ��ʱ��Y��Z����������֮��Ϊ2��3
D. c1��ȡֵ��ΧΪ0 mol��L-1<c1<0.14 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɽ���������������к����������ʻ�����ʽ�ǣ�COS������֪�ʻ�����ӽṹ��CO2���ƣ��й�˵����ȷ���ǣ� ��
A.�ʻ����ǵ����
B.�ʻ�����ӵĵ���ʽΪ��![]()
C.C��O��S����ԭ���а뾶��С����C
D.�ʻ������Ϊ�Ǽ��Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ϳ�������Ҫ�ɷ���һ����̼�������������ںϳɼ���(CH3OCH3)�����ȼ�ϡ�����Ȼ����øúϳ��������п��ܷ����ķ�Ӧ�У�
��CH4(g)+H2O(g)![]() CO(g)+3H2(g) ��H1��+206.1 kJ��mol-1
CO(g)+3H2(g) ��H1��+206.1 kJ��mol-1
��CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H2��+247.3 kJ��mol-1
2CO(g)+2H2(g) ��H2��+247.3 kJ��mol-1
��CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H3
CO2(g)+H2(g) ��H3
��ش��������⣺
��1����һ�ܱ������н��з�Ӧ�������CH4�����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ��ʾ������10 minʱ���ı���������������__________________________��

��2����Ӧ������H3��_____________��800 ��ʱ����Ӧ����ƽ�ⳣ��K��1����ø��¶����ܱ�������ijʱ�̸����ʵ����ʵ������±���
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
��ʱ��Ӧ���������淴Ӧ���ʵĹ�ϵʽ��_________(�����)��
a��v��>v�� b��v��<�� c��v����v�� d�����ж�
��3����ͼ2��ʾ���ڼס����������зֱ��������ʵ�����CH4��CO2��ʹ�ס�����������ʼ�ݻ���ȡ�����ͬ�¶��·�����Ӧ������ά�ַ�Ӧ�������¶Ȳ��䡣��֪��������CH4��ת������ʱ��ı仯��ͼ3��ʾ������ͼ3�л�����������CH4��ת������ʱ��仯��ͼ��___________

��4��ij�ϳ�������Ҫ�ɷ��е�һ����̼����һ��������Ҳ����NaOH��Һ��CO��Ӧ���ɼ�����(HCOONa)����һ����Ӧ���ɼ���������CO��Ⱦ�������½�a mol��COͨ��2 L b mol��L-1NaOH��Һ�У�ǡ����ȫ��Ӧ���ɼ����ƺͺ���������Ļ����Һ(������Һ�������)�������Һ��c(Na+)=c(HCOO-)����û����Һ�м���ĵ���ƽ�ⳣ��Ka=_________(�ú�a��b�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�ֽ��Ƶ�������һ�ֹ�ҵ����������ѭ�������������漰����������Ӧ��
I��SO2+2H2O+I2=H2SO4+2HI
II��2HI(g)H2(g)+I2(g)
III��2H2SO4=2SO2+O2+2H2O
��1��һ���¶��£���5L�����ܱ������м���1molHI��������ӦII��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��0��2min�ڵ�ƽ����Ӧ����v(HI)=___����ͬ�¶��£�����ʼ�����HI��Ϊ2mol����Ӧ��ƽ��ʱH2����Ϊ___mol��
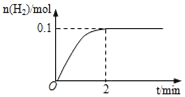
��2������������Ӧ�������жϴ������___����дѡ���ţ�ֻ��һ����ȷѡ���
a��������Ӧ��Ϊ������ԭ��Ӧ
b��ѭ�������в���1molH2��ͬʱ����1molO2
c���������ֽ�ˮ�Ĺ�����SO2��I2�൱�ڴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4L�ܱ������г���6molA�����5molB���壬��һ�������·�����Ӧ��3A(g)��B(g)![]() 2C(g)��xD(g)���ﵽƽ��ʱ��������2molC�����ⶨ��D��Ũ��Ϊ0.5mol��L��1���Լ��㣺��д���ļ�����̣�
2C(g)��xD(g)���ﵽƽ��ʱ��������2molC�����ⶨ��D��Ũ��Ϊ0.5mol��L��1���Լ��㣺��д���ļ�����̣�
��1��x��ֵΪ����________
��2��B��ת����Ϊ����________
��3��ƽ��ʱA��Ũ��Ϊ����________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᣨH2C2O4��������л���Ԫ�ᣬ���н�ǿ�Ļ�ԭ�ԣ���ҵ����Ҫ��������ҩ���Լ�����ϡ�н�����
��ҵ�Ͽ������·�Ӧ��ȡ���ᣨ������Ӧ��ΪҺ�෴Ӧ����
��4CO+4C4H9OH+O2![]() 2(COOC4H9)2+2H2O
2(COOC4H9)2+2H2O
��(COOC4H9)2+2H2O![]() H2C2O4+2C4H9OH��Q��Q��0��
H2C2O4+2C4H9OH��Q��Q��0��
��1����Ӧ��ѡ��13~15MPa�ĸ�ѹ�����½��У�����Ҫ��ԭ����Ϊ��___����5min��ˮ������������7.2g/L������ˮ��ʾ�ķ�Ӧ����Ϊ____��
��2�����ڷ�Ӧ���������ܹ�˵�����Ѿ��ﵽƽ�����____��
a��ƽ�ⳣ��K���ֲ��� b����ӦҺ��pH���ֲ���
c��������Ũ�ȱ��ֲ��� d����ӦҺ�����������ֲ���
���д�ʩ���ܼӿ�÷�Ӧ���ʣ�����������߲��ʵ���___��
a���������߷�Ӧ�¶� b����������Ӧѹǿ
c������ˮ������ d������ϡ������Ϊ����
��3�������ʵ���Ũ����ͬ�IJ�����Һ�����������Һ�������ϣ�����������ɫ��ζ�����壬д����Ӧ�Ļ�ѧ����ʽ____��
��4����֪����������Һ�����ԣ����д�ʩ��ʹ����������Һ��![]() ��С����___��
������___��
a��ͨ��HCl���� b��������ᾧ�� c��ͨ��NH3 d���������ؾ���
��5����֪�����ʵ���Ũ����ͬ�IJ�����Һ������������Һ�������ϣ���Ӧ�Ļ�ѧ����ʽΪ����H2C2O4+Na2SO3��NaHC2O4+NaHSO3��������Һ�����������������Һ��ϣ���Ӧ�Ļ�ѧ����ʽΪ����H2C2O4+2Na2SO3��Na2C2O4+2NaHSO3�������IJ�����Һ������������Һ��ϣ���Ӧ�Ļ�ѧ����ʽΪ����2H2C2O4+Na2SO3��2NaHC2O4+H2O+SO2��
����������Ϣ�жϲ�����������볣������ΪK1��K2������������������볣������ΪK3��K4���ɴ�С��˳��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaCl��CO2��NH3��H2O��NaHCO3����NH4Cl���Ǻ����Ƽ����Ҫ��Ӧ��������4λͬѧ�Ը÷�Ӧ�漰���й�֪ʶ�����IJ��ּ��⡣�������
A. ��ͬѧ˵����������NaHCO3���ܽ�Ƚ�С
B. ��ͬѧ˵�� NaHCO3���Ǵ���
C. ��ͬѧ˵������ NaHCO3��������Һ��ֻ���Ȼ��
D. ��ͬѧ˵���÷�Ӧ���ڱ���ʳ��ˮ����ͨ�백������ͨ�������̼
���𰸡�C
����������Ӧ��ֻ��̼�����Ƴ������ɣ����Ը�������NaHCO3���ܽ�Ƚ�С����A��ȷ��������Na2CO3��NaHCO3��С�մ�B��ȷ������ NaHCO3��������Һ����NaHCO3�ı�����Һ�����Ȼ����NaHCO3�ȣ���C�������ڱ���ʳ��ˮ����ͨ�백��ʹ��Һ�ʼ��ԣ���ͨ�������̼�����������̼���ܽ�ȣ���D��ȷ��
�����͡���ѡ��
��������
18
����Ŀ��NAΪ����٤��������ֵ������˵����ȷ����
A. 1mol OH�� ���еĵ�����ĿΪ NA
B. 1L 1 mol��L-1 Na2CO3 ��Һ�к��е� CO32����ĿΪ NA
C. 0.5mol ���к���̼̼˫������ĿΪ 1.5NA
D. 24 �� O3 ����ԭ�ӵ���ĿΪ 1.5NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com