
| A. | ①③⑤ | B. | ②③⑤ | C. | ②⑤ | D. | ①③④ |
 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:解答题
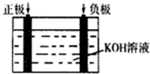
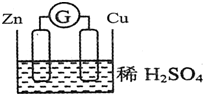 请观察如图装置,回答下列问题:
请观察如图装置,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
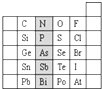 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.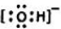 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-1nm) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
| A. | 元素⑤的氢化物沸点高于元素①的氢化物 | |
| B. | ③④处于同一周期 | |
| C. | 上述八种元素中,最高价氧化物对应水化物的酸性最强的是元素⑤ | |
| D. | ⑧号元素位于周期表中第三周期第ⅢA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有醛中都含醛基和烃基 | |
| B. | 一元醛的分子式符合CnH2nO的通式 | |
| C. | 醛的官能团是-COH | |
| D. | 所有醛都能使溴水和酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
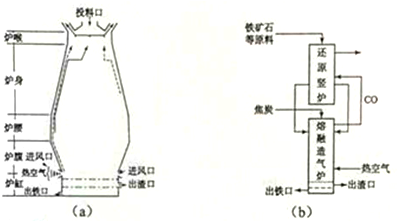
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中加入铝粉来制备H2:Al+2OH-+2H2O═AlO2-+3H2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 实验室用氢氧化钠溶液吸收Cl2:Cl2+OH-═Cl-+ClO-+H2O | |
| D. | 用胃舒平治疗胃酸过多:Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com