
【题目】表为元素周期表中的一部分,列出了10种元素在元素周期表中的位置.用化学符号回答下列各问题.
主族 | ||||||||
周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,第一电离能最大的是;电负性最小的金属是 .
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是 .
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是: .
(4)①和⑨的最高价氧化物对应水化物的化学式为和 . ①和⑨两元素形成化合物的化学式为;该化合物灼烧时的焰色为色;该化合物的溶液与元素⑧的单质反应的化学方程式为 .
(5)①和⑤最高价氧化物对应水化物相互反应的化学方程式为;离子方程式为 .
(6)用电子式表示第三周期元素中由电负性最小的元素和电负性最大的元素形成化合物的过程 .
【答案】
(1)Ar;K
(2)NaOH
(3)K+>Ca2+>Mg2+
(4)NaOH;HBrO4;NaBr;黄;2NaBr+Cl2═2NaCl+Br2
(5)NaOH+Al(OH)3═NaAlO2+2H2O;Al(OH)3+OH﹣═AlO2﹣+2H2O
(6)![]()
【解析】解:由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar.(1)稀有气体Ar的第一电离能最大;同周期自左而右电负性增大,同主族自上而下电负性减小,上述元素中K的电负性最小,所以答案是:Ar;K;(2)金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH的碱性最强,所以答案是:NaOH;(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:K+>Ca2+>Mg2+ , 所以答案是:K+>Ca2+>Mg2+;(4)①和⑨的最高价氧化物对应水化物分别为NaOH、HBrO4 , ①和⑨两元素形成化合物为NaBr,含有钠元素,焰色反应为黄色,溴化钠与氯气反应生成氯化钠与溴单质,反应方程式为:2NaBr+Cl2═2NaCl+Br2 , 所以答案是:NaOH;HBrO4;NaBr;黄;2NaBr+Cl2═2NaCl+Br2;(5)①和⑤最高价氧化物对应水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水,反应方程式为:NaOH+Al(OH)3═NaAlO2+2H2O,反应离子方程式为:Al(OH)3+OH﹣═AlO2﹣+2H2O,所以答案是:NaOH+Al(OH)3═NaAlO2+2H2O;Al(OH)3+OH﹣═AlO2﹣+2H2O;(6)第三周期元素中电负性最小的元素为Na、电负性最大的元素为Cl,反应中钠原子失去电子形成钠离子,氯原子获得电子形成氯离子,形成离子化合物NaCl,用电子式表示其形成过程为 ![]() ,所以答案是:
,所以答案是: ![]() .
.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】(1)浓硫酸与木炭粉在加热条件下反应的化学方程式为_______________________。
编号 | ① | ② | ③ | ④ |
装置 |
|
|
|
|
(2)试用表中所示各装置设计一个实验,验证上述反应所产生的各种产物。
这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号) → → → 。______________
(3)实验室中可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。B瓶溶液的作用是___________;C瓶溶液的作用是________________。
(4)装置②中所加的固体药品是__________。
(5)装置③中所盛的溶液是___________,可验证的产物是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl 2 通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO- 和ClO3-两种离子的物质的量( n )与反应时间( t )的变化示意图如图所示。 下列说法正确的是( )
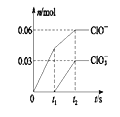
A. 苛性钾溶液中KOH的物质的量为0.18mol
B. 反应中转移电子的物质的量是0.09 mol
C. 在酸性条件下ClO- 和ClO3-能反应得到氯气
D. ClO3-的生成可能是由于温度升高引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式________________________________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为__________。
②利用H3PO2进行化学镀银反应中,当氧化产物为H3PO4时,氧化剂与还原剂的物质的量之比为__________。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿为自然界中铝的重要存在形式,通常含有 50﹪左右的 Al2O3,以及 SiO2、Fe2O3 和 MgO 等成分。上述 4 种氧化物中,属于两性氧化物的是
A. Al2O3 B. SiO2 C. Fe2O3 D. MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一铁的氧化物样品,用5mol/L盐酸140ml恰好完全溶解,所得溶液还能吸收标况下560ml氯气,Fe2+全部变成Fe3+,则该氧化物可能的化学式为
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合物能用溶解、过滤、蒸发三步操作分离的是( )
A. 水和酒精的混合物B. 食盐和蔗糖的混合物
C. 氯化钾和氯化银的混合物D. 硫酸钡和水的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com