
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 青铜是我国使用最早的合金 | 合金是指多种金属熔合成的金属材料 | Ⅰ错;Ⅱ对;无 |
| B | 精炼铜时,粗铜板作阳极 | 铜具有良好的导电性 | Ⅰ对;Ⅱ对;无 |
| C | 铜锌原电池中,铜是正极 | CuO和Cu2O都是黑色固体 | Ⅰ错;Ⅱ错;无 |
| D | CuO能与水反应生成Cu(OH)2 | 金属氧化物都能与水反应生成相应的金属氢氧化物 | Ⅰ对;Ⅱ对;有 |
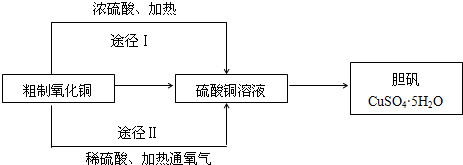
 2CuSO4+2H2O,故答案为:2Cu+O2+2H2SO4
2CuSO4+2H2O,故答案为:2Cu+O2+2H2SO4 2CuSO4+2H2O,CuO+H2SO4=CuSO4+H2O;
2CuSO4+2H2O,CuO+H2SO4=CuSO4+H2O;

科目:高中化学 来源: 题型:

| ||
| ||
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 青铜是我国使用最早的合金 | 合金是指多种金属熔合成的金属材料 | Ⅰ错;Ⅱ对;无 |
| B | 精炼铜时,粗铜板作阳极 | 铜具有良好的导电性 | Ⅰ对;Ⅱ对;无 |
| C | 铜锌原电池中,铜是正极 | CuO和Cu2O都是黑色固体 | Ⅰ错;Ⅱ错;无 |
| D | CuO能与水反应生成Cu(OH)2 | 金属氧化物都能与水反应生成相应的金属氢氧化物 | Ⅰ对;Ⅱ对;有 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 50.0g | 70.0g | 540.0g |
| 反应后 | 45.0g | 74.5g | 540.0g |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市普陀区高三上学期质量调研化学试卷(解析版) 题型:实验题
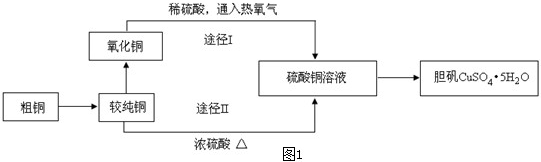
硫酸铜晶体俗称“胆矾”,在无机化工及生产生活中有广泛的应用。某课外研究小组的同学用粗铜粉(含有碳等杂质)设计了两种制备胆矾的途径,并测定了其中结晶水的含量。设计的流程如下:

(1)“较纯铜”转化为氧化铜时,应将其置于 内进行灼烧(填写仪器名称)。“粗铜”表面的油脂可以用热碱溶液洗去,原因是 。若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜。存在少量铜的可能原因是 。
a.灼烧过程中部分氧化铜被还原 b.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧不充分铜未被完全氧化
(2)通过途径I实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。比较由粗制氧化铜制取胆矾的两种途径,途径Ⅰ有明显的两个优点:
① 。
② 。
(3)测定胆矾晶体里结晶水的含量时,若测定的相对误差大于零,则产生误差的原因可能是___________。
a.加热后容器未放入干燥器中冷却
b.最后两次加热后的质量相差较大
c.加热前称量时容器未完全干燥
d.加热过程中有少量溅失
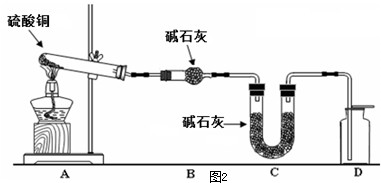
(4)利用下图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量见图下方的表格所示。
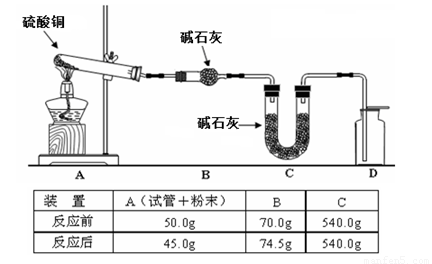
请通过计算,推断该实验条件下硫酸铜分解的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2010年广东省广州市高考化学模拟试卷(四)(解析版) 题型:填空题

| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 青铜是我国使用最早的合金 | 合金是指多种金属熔合成的金属材料 | Ⅰ错;Ⅱ对;无 |
| B | 精炼铜时,粗铜板作阳极 | 铜具有良好的导电性 | Ⅰ对;Ⅱ对;无 |
| C | 铜锌原电池中,铜是正极 | CuO和Cu2O都是黑色固体 | Ⅰ错;Ⅱ错;无 |
| D | CuO能与水反应生成Cu(OH)2 | 金属氧化物都能与水反应生成相应的金属氢氧化物 | Ⅰ对;Ⅱ对;有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com