
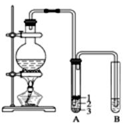
 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:分析 (1)由图可知,仪器的名称;NaBr与浓硫酸反应生成HBr,HBr与乙醇发生取代反应生成溴乙烷;
(2)冰水混合物可冷却生成物,溴乙烷的密度比水大;
(3)结合反应可知生成物;
(4)试管A中获得的有机物呈棕黄色,含溴单质,溴乙烷、溴均与碱反应,但溴乙烷与亚硫酸钠不反应,反应后分液可分离;
(5)乙烯能被高锰酸钾氧化;
解答 解:(1)由图可知,盛放反应物的仪器名称是圆底烧瓶;其中加入的反应物是溴化钠、乙醇和1:1的硫酸;故答案为:圆底烧瓶;乙醇;
(2)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是冷却、液封溴乙烷,溴乙烷的密度比水大,则产物在第3层,
故答案为:冷却、液封溴乙烷;3;
(3)由NaBr+H2SO4═HBr+NaHSO4、CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O可知,试管A中除了产物和水之外,还可能存在HBr、CH3CH2OH,
故答案为:HBr;CH3CH2OH;
(4)试管A中获得的有机物呈棕黄色,含溴单质,溴乙烷、溴均与碱反应,但溴乙烷与亚硫酸钠不反应,则选择除杂试剂为d;故答案为:d;
(5)乙醇在浓硫酸作用下可发生消去反应生成乙烯,能被高锰酸钾氧化,可知试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是乙烯,
故答案为:乙烯.
点评 本题考查制备实验方案的设计,为高频考点,把握制备实验原理、实验装置的作用、习题中的信息为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

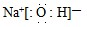 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
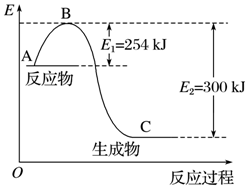 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com