
分析 (1)玻璃、二氧化硅都含有硅元素;
(2)依据浓硫酸、浓硝酸的强的氧化性解答;
(3)依据次氯酸化学式解答;
(4)氨气与氯气发生氧化还原反应生成氮气和氯化氢,氯化氢与氨气反应生成白色的氯化铵固体;
(5)氮气与氧气在放电条件下生成一氧化氮;
(6)依据二氧化硫的漂白性解答.
解答 解:(1)玻璃、二氧化硅都含有硅元素;
故答案为:玻璃 水泥;
(2)浓硫酸、浓硝酸具有强的氧化性,常温下能够使铁、铝钝化,在表面被氧化为致密的氧化物薄膜阻止反应进行,常温下可以用铁、铝制容器来盛装浓硫酸或者浓硝酸;
故答案为:钝化或表面被氧化为致密的氧化物薄膜
(3)次氯酸化学式:HClO,故答案为:HClO;
(4)氨气与氯气发生氧化还原反应生成氮气和氯化氢,氯化氢与氨气反应生成白色的氯化铵固体,产生大量白烟,可以用浓氨水来检验氯气管道是否漏气;
故答案为:产生白烟;NH3+HCl=NH4Cl;
(5)氮气与氧气在放电条件下生成一氧化氮,方程式:N2+O2=2NO,故答案为:N2+O2=2NO;
(6)二氧化硫具有漂白性,但是二氧化硫有毒,不能漂白食品,故答案为:漂白.
点评 本题考查了元素化合物知识,熟悉硅及化合物、浓硫酸、浓硝酸、次氯酸、二氧化硫的性质是解题关键,题目难度不大,注意对基础知识的积累.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 通式为CnH2n的烃一定能使酸性高锰酸钾溶液褪色 | |
| B. | 通式为CnH2n-2的烃一定是炔烃 | |
| C. | 分子式为C4H8的烃不一定能使溴水褪色 | |
| D. | 芳香烃的通式为CnH2n-6(n≥6) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
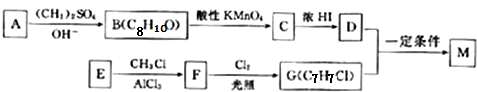
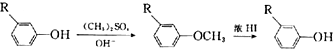
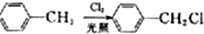
 ;E→F的反应类型为取代反应.
;E→F的反应类型为取代反应.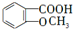 +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$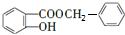 +HCl
+HCl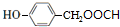 (写结构简式).
(写结构简式). 和(CH2)3CCl为起始原料制备
和(CH2)3CCl为起始原料制备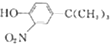 的合成路线:
的合成路线: $→_{AlCl_{3}}^{(CH_{3})_{3}CCl}$
$→_{AlCl_{3}}^{(CH_{3})_{3}CCl}$ $→_{OH-}^{(CH_{3})_{2}SO_{4}}$
$→_{OH-}^{(CH_{3})_{2}SO_{4}}$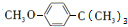 $→_{浓H_{2}O_{4}/△}^{浓HNO_{3}}$
$→_{浓H_{2}O_{4}/△}^{浓HNO_{3}}$ $\stackrel{浓HI}{→}$
$\stackrel{浓HI}{→}$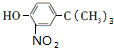 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,Zn为负极,负极区PH变大 | |
| B. | 电池负极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,电子由正极流向负极 | |
| D. | 电解质氢氧化钾溶液中阳离子迁移到电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫 | |
| B. | 铜与浓硫酸反应产生二氧化硫,而锌与浓硫酸反应产生氢气 | |
| C. | 二氧化硅是酸性氧化物能和烧碱溶液反应 | |
| D. | 在常温下,浓硫酸不与铜反应,是因为铜被钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
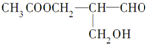 )有光学活性.则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
)有光学活性.则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )| A. | 与乙酸发生酯化反应 | B. | 与NaOH水溶液共热 | ||
| C. | 与银氨溶液作用 | D. | 在催化剂存在下与氢气作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①→②→③→④ | B. | ①→③→②→④ | C. | ①→③→④→② | D. | ①→④→②→③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HPO32-既能电离也能水解 | |
| B. | Na2HPO3溶液一定呈碱性 | |
| C. | H3PO3具有还原性 | |
| D. | H3PO3的溶液中加入过量NaOH,生成Na3PO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃时,0.001mol•L-1的NaOH溶液pH=11 | |
| B. | 若溶液中c(H+)与c(OH-)相等,溶液肯定呈中性 | |
| C. | 25℃,0.001mol/LH2SO4溶液中,水电离出的c(OH-)为10-11mol/L | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com