
(14分)
氢溴酸在工业和医药领域中有着广泛的用途,下图是某兴趣小组模拟工厂制备氢溴酸粗品并精制的流程如下:
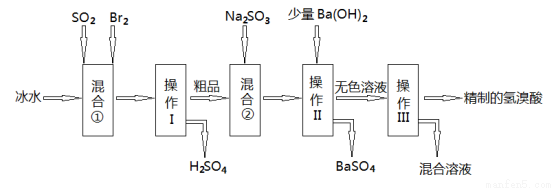
(1)混合①使用冰水的目的是 ;
(2)操作II和III的名称是 , ;
(3)混合②中发生反应的离子方程式为 ;
(4)工业上用氢溴酸和大理石制得溴化钙中含有少量Al3+、Fe3+杂质,加入适量的试剂 (填化学式)后控制溶液的PH约为8.0即可除去杂质,控制溶液的PH约为8.0的目的是_______________________________________________________;
(5)t℃时,将HBr通入AgNO3溶液中生成的AgBr在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgCl的Ksp=4×l0-10,下列说法不正确的是 ( )
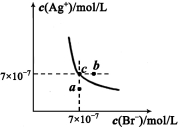
A.向含有Cl- 和Br- 的混合液中滴加硝酸银溶液,一定先产生AgBr的沉淀
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数Κ≈816
AgBr(s)+Cl-(aq)平衡常数Κ≈816
(每空2分)
(1)降低体系的温度,防止溴的挥发(2分)
(2)过滤,蒸馏(各2分)
(3) Br2+SO32-+H2O=2Br-+SO42-+2H+(2分)
(4) CaO或Ca(OH)2或CaCO3,确保Fe3+和Al3+沉淀完全和防止氢氧化铝溶解(各2分)
(5)AB(2分)
【解析】
试题分析:(1)Br2氧化SO2放出很多热量,溴易挥发,使用冰水,降低体系温度,防止溴蒸发,使反应完全。
(2)由工艺流程可知,操作Ⅱ分离固体与液体,应是过滤;操作Ⅲ为互溶的溶液组分的分离,应是蒸馏。
(3)混合②中加入Na2SO3,Na2SO3具有还原性,被Br2氧化,所以离子方程式为:Br2+SO32-+H2O=2Br-+SO42-+2H+
(4)目的是制取CaBr2,通过控制溶液的PH约为8.0即可除去杂质Al3+、Fe3+,为了防止新杂质的进入,应加入含Ca元素且能与H+反应的物质,如CaO或Ca(OH)2或CaCO3;控制溶液的PH约为8.0时,Al3+、Fe3+转为Al(OH)3和Fe(OH)3沉淀而除去,所以控制溶液的PH约为8.0的目的是确保Fe3+和Al3+沉淀完全和防止氢氧化铝溶解。
(5)A、根据图中c点坐标可求出AgBr的Ksp=7×10-7×7×10-7= 4.9×10-13,小于AgCl的Ksp,但选项中没有给出Cl?和Br?浓度,所以不一定先产生AgBr的沉淀,错误;B、在AgBr饱和溶液中加入NaBr固体,沉淀溶解平衡移动后溶液仍为饱和溶液,不可能由c点到b点,错误;C、a点在溶解平衡曲线以下,所以a点对应的是AgBr的不饱和溶液,正确;D、在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数Κ=c(Cl?)/c(Br?)= c(Cl?)?c(Ag+)/c(Br?) ?c(Ag+)=Ksp(AgCl)/ Ksp(AgBr)= 4×l0-10/4.9×10-13≈816,正确。
AgBr(s)+Cl-(aq)平衡常数Κ=c(Cl?)/c(Br?)= c(Cl?)?c(Ag+)/c(Br?) ?c(Ag+)=Ksp(AgCl)/ Ksp(AgBr)= 4×l0-10/4.9×10-13≈816,正确。
考点:本题考查化学流程的分析、基本操作、除杂、沉淀溶解平衡。


科目:高中化学 来源:2013-2014安徽省高二(下)期末考试化学试卷(解析版) 题型:选择题
羰基硫(OCS)是一种有臭鸡蛋气味的无色气体,分子结构与CO2相似,高温下分解为CO和S。下列有关说法正确的是( )
A.OCS、CO2、CO、S晶体类型相同
B.OCS高温分解时,碳元素化合价升高
C.OCS中含有1个σ键和1个π键
D.22.4 L OCS中约含有3×6.02× 1023个原子
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:选择题
根据下表中部分短周期元素的原子半径及主要化合价信息:
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
请判断以下叙述正确的是( )
A.氢化物的沸点为H2T<H2R B. L2+与R2-的核外电子数相等
C.与稀盐酸反应单质Q比单质L快 D.M与T形成的化合物具有两性
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省合肥市高三第三次教学质量检测理综化学试卷(解析版) 题型:填空题
(15分)下表中列出五种短周期元素X、Y、Z、W、T的信息。
元素 | 相关信息 |
X | 基态原子最外层电子排布为nsnnpn+1 |
Y | 其原子L层电子数是K层3倍 |
Z | 其单质能与冷水剧烈反应,生成的阴阳离子电子数相同 |
W | 其单质在Y2中燃烧,发出明亮的蓝紫色火焰 |
T | 其最高正价与最低负价的代数和为6 |
回答下列问题:
(1)Y、Z、W三种元素所形成的简单离子半径由小到大的顺序是 (用离子符号表示);T元素的基态原子核外电子排布式为 。
(2)X、Z两元素可形成化合物ZX3,其晶体中化学键类型有 ,晶体类型为 。
(3)T元素的最高价氧化物对应水化物的化学式是 H2Y的沸点比H2W高的原因是 。
(4) Z2 WY3溶液呈 性,其原因是(用离子方程式表示) 。
(5)已知25℃、101 kPa下:
①2Z(s)+ 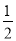 Y2(s)=Z2Y(s) △H1=-414KJ/mol
Y2(s)=Z2Y(s) △H1=-414KJ/mol
②2Z(s)+ Y2(s)=Z2Y2(s) △H1=-511KJ/mol
则1mol Z2 Y2(S)与足量Z(s)反应生成Z2 Y(s)的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省合肥市高三第三次教学质量检测理综化学试卷(解析版) 题型:选择题
三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如下图所示。下列有关三硫化四磷说法中正确的是
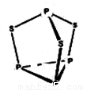
A.该物质中磷元素的化合价为+3
B.该物质分子中含有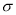 键和
键和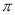 键
键
C.该物质的熔、沸点比食盐高
D.该物质22g含硫原子的数目约为1.806×1023
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏银川市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列热化学方程式或离子方程式中,正确的是
A.0.01mol·L-1NH4Al(SO4)2溶液与0.02mol·L-1Ba(OH)2溶液等体积混合:
NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
B.一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
N2(g)+3H2(g) 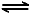 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
C.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓
D.CO(g)的燃烧热是283.0 kJ·mol-1,则CO2分解的热化学方程式为:
2CO2(g) =2CO(g)+O2(g) ΔH=+283.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:填空题
(8分)元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期中电负性最大的。请回答:
(1)A原子的核外电子排布的轨道表示式________,B原子的核外电子排布式__________________,C原子的价电子排布式________。
(2)A、B、C的气态氢化物中最不稳定的是________(填化学式)。
(3) A、B、C的最高价氧化物的水化物中,酸性最强的是________。
(4)AC4的结构式为________,中心原子A的杂化方式________杂化,是________(填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:选择题
中心原子采取sp2杂化的是 ( )
A.NH3 B.BCl3 C.PCl3 D.H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高一下学期期中考试化学试卷(解析版) 题型:选择题
关于元素周期表的说法正确的是( )
A.元素周期表有8个主族 B.元素周期表有7个周期
C.短周期是指第一、二周期 D.IA族的元素全部是金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com