
 已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.
已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.分析 (1)根据混合气体中有三氧化硫,NaHSO3能与三氧化硫反应生成Na2SO4、H2O和SO2;
(2)根据浓硫酸可作干燥剂;根据SO2能与碱石灰反应,而氧气与与碱石灰不反应;
(3)根据量筒内液体的体积即为O2的体积,根据n=$\frac{V}{{V}_{m}}$来分析;根据干燥管增重的质量为SO2的质量(包括原来的和通NaHSO3后生成的),再根据电子得失守恒n(O2)×4=n(SO2)×2求出分解产生的SO2的物质的量,最后根据方程式SO3+2NaHSO3=Na2SO4+H2O+2SO2↑求出SO3的物质的量.
解答 解:(1)混合气体中有三氧化硫,NaHSO3能与三氧化硫反应生成Na2SO4、H2O和SO2:SO3+2NaHSO3=Na2SO4+H2O+2SO2↑,可NaHSO3来除去三氧化硫,
故答案为:吸收生成的SO3气体;SO3+2NaHSO3=Na2SO4+H2O+2SO2↑;
(2)浓硫酸可作干燥剂,可吸收SO2和O2中的水蒸气;
SO2能与碱石灰反应,而氧气与与碱石灰不反应,所以干燥管收集到的物质是SO2,
故答案为:干燥SO2和O2;SO2;
(3)量筒内液体的体积即为O2的体积,其物质的量为:$\frac{0.112L}{22.4L/mol}$=0.005mol,根据电子得失守恒n(O2)×4=n(SO2)×2,即0.005mol×4=n(SO2)×2,则n(SO2)=0.01mol,干燥管增重的质量为SO2的质量(包括原来的和通NaHSO3后生成的)为1.28g,物质的量为0.02mol,所以与NaHSO3反应生成的SO2为0.01mol,由方程式SO3+2NaHSO3=Na2SO4+H2O+2SO2↑可知SO3的物质的量为0.005mol,
故答案为:0.005;0.01;0.005.
点评 本题了探究物质组成、测量物质含量的方法,题目难度中等,在计算时要抓住电子得失守恒,尤其要注意干燥管增重的质量为SO2的质量包括原来的和通NaHSO3后生成的,试题培养了学生的分析能力及化学实验能力.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变 | |
| B. | pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L | |
| C. | 饱和氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) | |
| D. | 0.1mol/L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的比例模型: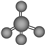 | |
| B. | 氯离子的结构示意图: | |
| C. | CH3CH2CH3和CH3CH2CH2CH3互为同分异构体 | |
| D. | KCl的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2248Ti和2250Ti原子中均含有22个中子 | |
| B. | 2248Ti和2250Ti在周期表中位置相同,都在第4纵行 | |
| C. | 分别由2248Ti和2250Ti组成的金属钛单质互称为同分异构体 | |
| D. | 2248Ti和2250Ti为同一核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
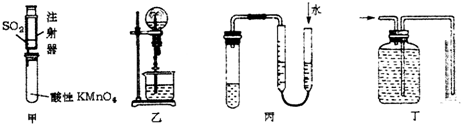
| A. | 可用甲装置来探究SO2的漂白性 | |
| B. | 可用乙装置验证HCl气体极易溶于水 | |
| C. | 用图示的方法可以检查丙装置的气密性 | |
| D. | 可用丁装置测量铜与稀硝酸反应生成气体的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com