
一些简单原子的原子结构可用下图①、②、③形象地表示:

根据该图的示意,则下列有关图①、②、③所表示的原子叙述正确的是
A.①②③互为同位素 B.①②③为同素异形体
C.①②③为同种原子 D.①②③具有相同的质量数
科目:高中化学 来源: 题型:

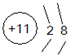
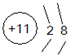


查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| A | A的基态原子最外层电子排布式为2S22P3 |
| B | B是地壳中含量最高的元素 |
| C | C+与B的简单离子的电子层结构相同 |
| D | D的一种核素的质量数为64,中子数为35 |
| E、F | E、F既同周期又同族,且原子序数F比E多2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
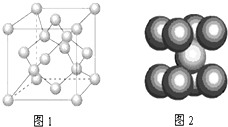 A、B、C为原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子结构为nsnnpn,C元素原子的第一电离能在同族元素中最大并且高于同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子结构为3d64s2,请回答:
A、B、C为原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子结构为nsnnpn,C元素原子的第一电离能在同族元素中最大并且高于同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子结构为3d64s2,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
(1)指出E元素在周期表中的位置:___________________________________________。
画出B的轨道表示式:_____________________________________________________。
写出C的电子排布式:____________________________________________________。
(2)A、B、C、D、E五原子的原子半径由大到小的顺序是______________(用元素符号表示,下同)。
(3)A、B、C、D、E五元素形成的简单离子的离子半径由大到小的顺序是_____________。
(4)比较B、E分别与A形成的简单化合物的沸点高低,并简要说明原因。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com