
【题目】下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)═CO2(g);△H1 C(s)+ ![]() O2(g)═CO(g);△H2
O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+ ![]() O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8 .
A.①
B.④
C.②③④
D.①②③
科目:高中化学 来源: 题型:
【题目】按下列四种有关性质的叙述,可能属于金属晶体的是 ( )
A. 由分子间作用力结合而成,熔点很低
B. 固体易导电,熔点在1 000 ℃左右
C. 由共价键结合成网状晶体,熔点很高
D. 固体不导电,但溶于水或熔融后能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.共价化合物中一定不含离子键
B.离子化合物中一定不含共价键
C.任何化学物质中均存在化学键
D.全部由非金属元素形成的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是( )
A.淀粉 ![]() 葡萄糖
葡萄糖 ![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B.纤维素 ![]() 葡萄糖
葡萄糖 ![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C.油脂 ![]() 甘油和高级脂肪酸
甘油和高级脂肪酸 ![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D.蛋白质 ![]() 氨基酸
氨基酸 ![]() 人体所需的蛋白质(人体生长发育、新陈代谢)
人体所需的蛋白质(人体生长发育、新陈代谢)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池工作原理如图所示。在电解质溶液中发生的电池总反应为:VO2+(蓝色)+H2O+V3+(紫色)![]() VO2+(黄色)+V2+(绿色)+2H+。下列说法正确的是( )
VO2+(黄色)+V2+(绿色)+2H+。下列说法正确的是( )

A. 当电池无法放电时,只要更换电解质溶液,不用外接电源进行充电就可正常工作
B. 放电时,负极反应为VO2++2H++e-=VO2++H2O
C. 放电时,正极附近溶液由紫色变绿色
D. 放电过程中,正极附近溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当前能源危机是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法不利于能源“开源节流”的是________(填字母)。
A.开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料
B.研究采煤、采油新技术,提高产量以满足工业生产的快速发展
C.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
D.减少资源消耗、增加资源的重复使用和资源的循环再生

(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。则在通常状况下,金刚石和石墨相比较,_________(填 “金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH=______________。
(3)N2、O2分子中化学键的键能分别是946 kJ/mol、497kJ/mol。已知:N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ/mol。NO分子中化学键的键能为_____。
(4)综合上述有关信息,请写出用CO除去NO生成无污染气体的热化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表和元素周期律的说法正确的是
A. Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B. 第二周期元素从Li到F,非金属性逐渐增强
C. 因为Na比K容易失去电子,所以Na比K的还原性强
D. O与S为同主族元素,且O比S的非金属性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.
(1)①已知C(s)+H2O(g)═CO(g)+H2(g)△H1=+131.3kJmol﹣1
C(s)+2H2O(g)═CO2(g)+2H2(g)△H2=+90kJmol﹣1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 .
(2)将燃烧废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①该反应平衡常数表达式为K= .
②若温度不变,减小反应投料比[ ![]() ],则K将(填“增大”“减小”或“不变”).
],则K将(填“增大”“减小”或“不变”).
(3)通过水煤气合成二甲醚的热化学方程式如下:
3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g)△H=﹣aKJ/mol
该反应在一定条件下的密闭容器中可达到平衡状态(曲线1),若在t0时刻改变一个条件,曲线I变为曲线Ⅱ,改变的条件是 . (填字母编号)
A.升高温度
B.加入催化剂
C.缩小容器体积
D.增加H2的浓度
E.分离出二甲醚.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气部分氧化制取的化工原料气中,常含有氧硫化碳(COS,结构类似于CO2),目前氧硫化碳脱除可采用氢解和水解两种方法,其反应原理如下:
氢解:COS(g)+H2(g)![]() H2S(g)+CO(g)
H2S(g)+CO(g)
水解:COS(g)+H2O(g)![]() H2S(g)+CO2(g)
H2S(g)+CO2(g)
(1)氧硫化碳的电子式为________________________________。
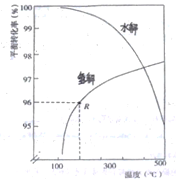
(2)如下图是氧硫化碳水解和氢解平衡转化率随温度变化曲线。
①观察图像,水解与氢解相比优势为_________________________________。
②水解的△H___0(填“大于"或“小于”)
③已知:1molCOS(g)完全氢解能量变化为6.99kJ,若初始COS的物质的量为nmol,从反应开始到R点所示体系的能量变化为______kJ(只列式,不必计算)。
(3)氢解和水解产生的H2S必须进行回收处理,酸性、可溶性铁盐氧化H2S制取硫磺工艺备受重视。
①写出酸性条件下用氢氧化铁溶液吸收H2S制取硫磺的离子方程式___________________________。
②吸收H2S后的酸性废液中的Fe2+,可通过电解法使Fe3+再生,写出电解时总反应的离子方程式:__________。
③常温下,在c(H+)=0.30mo/L的酸性溶液中通入H2S至饱和,测得硫化氢的平衡浓度为0.10mol/L,计算此时溶液中c(S2-)=_______[忽略H2S电离生成的H+,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.0×10-15,结果保留两位有效数字。]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com