
氯原子对O3分解有催化作用:
O3 + Cl =ClO + O2 ΔH1 ClO + O =Cl + O2 ΔH2
大气臭氧层的分解反应是:O3 + O=2O2 ΔH,该反应的能量变化如图:
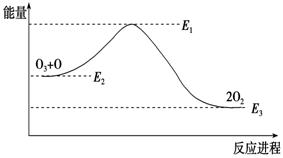
下列叙述中,正确的是( )
A.反应O3 + O =2O2的ΔH=E1-E3 B.O3 + O =2O2是吸热反应
C.ΔH=ΔH1+ΔH2 D.大气层中的臭氧无法再生
科目:高中化学 来源: 题型:
下列说法正确的是( )。
A.复分解反应中有的是氧化还原反应,有的不是氧化还原反应
B.置换反应有可能是非氧化还原反应
C.化合反应一定是氧化还原反应
D.分解反应不一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 1L 1mol·L-1的NaClO 溶液中含有ClO-的数目为NA
B.标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA
C.铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标况下)
D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为 ,CO有多种等电子体,其中常见的一种分子是 。利用CO可以合成化工原料COCl2、配合物Fe(CO)5等,已知一个COCl2分子中每个原子最外层都形成8电子的稳定结构,则一个COCl2分子内含有 个δ键,C原子的杂化方式为 。Fe(CO)5等在一定条件下分解生成CO和铁,反应过程中断裂的化学键是 ,形成的化学键是 。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
写出A原子的电子排布图 ,Al原子的第一电离能 (填:“大于”、“小于”或“等于”)738 kJ·mol-1,原因是 。
(3)下图是一种镍(Ni)镧(La)合金储氢后的晶胞结构图。该合金储氢后,含0.5mol Ni的合金可吸附氢气的体积(标况)为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
完全燃烧一定量的乙醇,放出的热量为Q,为完全吸收生成的CO2,并使之生成正盐Na2CO3,消耗掉0.8mol/L NaOH溶液500mL,则相同条件下燃烧1mol乙醇放出的热量是( )
A. 0.2Q B. 0.1Q
C. 5Q D. 10Q
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1 mol Cl2参与反应时释放145 kJ的热量,写出这个热化学方程式__________________________________________。
(2)家用液化气中的主要成分之一是丁烷,当10 kg丁烷完全燃烧并生成CO2和液态水时,放出的热量是5×105 kJ,则丁烷的燃烧热ΔH=___________。已知1 mol液态水汽化时需要吸收44 kJ的热量,则反应:C4H10(g)+ O2(g)===4CO2(g)+5H2O(g)的ΔH=________kJ·mol-1。
O2(g)===4CO2(g)+5H2O(g)的ΔH=________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
CH 、—CH3、CH
、—CH3、CH 都是重要的有机反应中间体,有关它们的说法不正确的是
都是重要的有机反应中间体,有关它们的说法不正确的是
A.它们均由甲烷去掉一个氢原子所得
B.CH 与NH3、H3O+互为等电子体,几何构型均为三角锥形
与NH3、H3O+互为等电子体,几何构型均为三角锥形
C.CH 中的碳原子采取sp2杂化,所有原子均共面
中的碳原子采取sp2杂化,所有原子均共面
D.两个—CH3或一个CH 和一个CH
和一个CH 结合均可得到CH3CH3
结合均可得到CH3CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:

回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe === 3Fe2+
2TiO2+(无色) +Fe+4H+ === 2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O === TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在_____________范围。
(3)若把③中制得的固体TiO2·n H2O用酸清洗除去其中的Fe (OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe (OH)3+3H+ Fe3+ +H2O的
Fe3+ +H2O的 平衡常数K=_____________。
平衡常数K=_____________。
(4)已知:TiO2 (s) +2 Cl2 (g)=== TiCl4(l) +O2(g) △H=+140KJ·mol-1
2C(s) +O2(g)=== 2CO(g) △H=—221KJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:_____________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
| TiCl4 | SiCl4 | |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com