
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | CH3OH的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | |||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | Ⅰ中反应在0-40min内的平均速率为υ(H2)=0.0020mol•L-1•min-1 | |
| B. | 达到平衡时,容器Ⅰ中的反应物转化率比容器Ⅱ中的大 | |
| C. | 三个容器中反应的平衡常数关系为Ⅱ=Ⅰ>Ⅲ | |
| D. | 达若起始时向容器Ⅰ中充入0.020molH2、0.010molCO和0.010molCH3OH |
分析 对比Ⅰ、Ⅲ,如温度相同,0.1mol/L的CH3OH相当于0.20mol/L的H2和0.1mol/L的CO,为等效平衡,但Ⅲ温度较高,平衡时CH3OH较低,说明升高温度平衡逆向移动,正反应为放热反应,对比Ⅰ、Ⅱ,在相同温度下反应,但Ⅱ浓度较大,由方程式可知,增大浓度,平衡正向移动,以此解答该题.
A.根据v=$\frac{△c}{△t}$计算Ⅰ中反应在0-40min内的平均速率为υ(H2);
B.相同温度下,Ⅱ中反应物浓度是Ⅰ的起始浓度的2倍,相同于将Ⅰ的体积缩小一半,平衡向化学计量数减小的方向移动,由此判断转化率的变化;
C.平衡常数受温度影响,改变温度如果平衡正向移动,平衡常数增大;
D.根据Qc判断是否是平衡状态.
解答 解:A.Ⅰ中反应在0-40min内v(CH3OH)=$\frac{0.080mol/L}{40min}$=0.0020mol•L-1•min-1,则v(H2)=0.0040mol•L-1•min-1,故A错误;
B.对比Ⅰ、Ⅱ,在相同温度下反应,但Ⅱ浓度较大,由方程式2H2(g)+CO(g)?CH3OH(g)可知,增大浓度,平衡正向移动,该反应正向为体积减小的反应,增大浓度转化率会增大,则容器Ⅰ中反应物转化率比容器Ⅱ中的小,故B错误;
C.由以上分析可知,正反应为放热反应,则升高温度,平衡常数减小,Ⅱ=Ⅰ>Ⅲ,故C正确;
D.由Ⅰ可知K=$\frac{0.08}{0.1{2}^{2.}×0.02}$=277.8,若起始时向容器Ⅰ中充入0.020molH2、0.010molCO和0.010molCH3OH,则Qc=$\frac{0.010}{0.02{0}^{2}×0.010}$=2500,没有达到平衡状态,故D错误;故选C.
点评 本题考查了化学平衡的有关计算、化学反应速率的影响,涉及等效平衡问题,侧重于学生的分析能力的考查,题目难度中等,但易错,答题时注意把握反应的特点以及平衡的影响因素.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 用玻璃杯蘸取某溶液进行焰火反应实验 | 火焰呈黄色 | 溶液中含有Na+ |
| C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别用于清洗做完眼镜反应的试管 | 用FeCl3溶液清洗比Fe2(SO4)3溶液清洗得干净 | Fe3+氧化银单质的过程可能是一个可逆过程: Fe3++Ag?Fe2++Ag+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | ||
| A | 25 | 5 | 0.1 | 20 | 0.1 |
| B | 25 | 5 | 0.2 | 10 | 0.2 |
| C | 35 | 5 | 0.1 | 20 | 0.1 |
| D | 35 | 5 | 0.2 | 10 | 0.2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含lmolH2SO4的浓硫酸与足量铜在加热条件下反应,转移的电子总数为NA | |
| B. | 0.1 L0.5mol/LCH3COOH 溶液中含有的氢离子为0.05NA | |
| C. | 粗铜精炼时阳极质量减少6.4g,则外电路上通过0.2NA电子 | |
| D. | 1molCH3COONa和少量CH3COOH溶于水所得到的中性溶液中,CH3COO-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
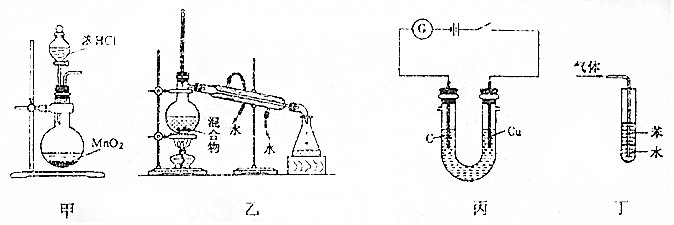
| A. | 利用装置甲制取氯气 | |
| B. | 利用装置乙分离乙酸(沸点:118℃)与乙酸乙酯(沸点:77.1℃) | |
| C. | 利用装置丙可电解食盐水制氯气和氢气 | |
| D. | 利用装置丁吸收NH3,并防止倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C与12C是两种不同的元素或核素 | |
| B. | 通过化学变化可以实现16O与18O之间的相互转化 | |
| C. | 35Cl2与37Cl2互为同素异形体 | |
| D. | 铯元素的两种同位素中137Cs比133Cs多4个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A.运石油的油罐车上应贴  标志,并由专人押运 标志,并由专人押运 | |
| B. | 不慎将酒精洒到桌面上引起着火,可用水扑灭 | |
| C. | 氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用硼酸稀溶液冲洗 | |
| D. | 右图装置可分离CH3COOC2H5和碳酸钠饱和溶液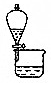 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
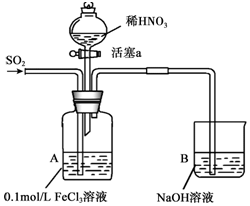 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)| 实验序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液迅速变成深红棕色,最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液. | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a | A中浅绿色溶液最终变为黄色. |
| IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中通入空气. | 溶液变为红色;液面上方有少量红棕色气体生成. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com