
【题目】高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的净化处理。某工厂欲以工业废料(金属铁、铝及其氧化物)为原料、采用如下流程来制取PAFC:
![]()
下列判断无法确定的是
A.PAFC因水解而能净水B.往甲溶液中滴入KSCN溶液后呈血红色
C.试剂X具有氧化性D.乙溶液呈酸性
【答案】B
【解析】
废料中加入过量稀盐酸,充分反应后得到甲溶液,甲溶液中含有AlCl3,由于Al、Fe以及Fe2O3的物质的量关系无法确定,则不能确定溶液中Fe元素的存在形成,不能确定是存在Fe2+还是Fe3+或是二者都有,加入X应为氧化剂,可将Fe2+生成Fe3+,加入NaOH溶液后,调节溶液pH,可生成目标物,以此解答该题。
A、[AlFe(OH)nCl6-n]m可水解生成氢氧化铝和氢氧化铁胶体,具有吸附性,可用于净水,故A不选;
B、由于Al、Fe以及Fe2O3的物质的量关系无法确定,则不能确定溶液中Fe元素的存在形成,不能确定是存在Fe2+还是Fe3+或是二者都有,则加入KSCN溶液后溶液不一定成血红色,故B选;
C、加入X应为氧化剂,可将Fe2+生成Fe3+,因[AlFe(OH)nCl6-n]m中Fe为+3价,可起到净水剂的作用,故C不选;
D、如呈强碱性,则不可能生成[AlFe(OH)nCl6-n]m,因氢氧化铝与氢氧化钠反应生成偏铝酸钠,因此乙溶液呈酸性,故D不选;
故选B。


科目:高中化学 来源: 题型:
【题目】化学家格哈德·埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

![]()
下列关于合成氨反应的叙述中不正确的是
A. 该过程表明,在化学反应中存在化学键的断裂与形成
B. 在催化剂的作用下,反应物的化学键变得容易断裂
C. 过程②需吸收能量,过程③则放出能量
D. 常温下该反应难以进行,是因为常温下生成物的化学键难以形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿样用过量酸溶解并过滤,所得滤液A主要含CO32-、Ni2+、SO42-、H+、Fe2+、Fe3+、OH-、Mg2+、Mn2+等九种离子中的七种。将A中金属元素进行分离以备利用,部分流程如图所示:

可能用到的有关数据如下:

请根据题给信息填空:
(1)滤液A中不能大量存在的两种离子是________。
(2)已知“滤渣1”是MnO2,步骤①发生的氧化还原反应的离子方程式为________。
(3)常温下,某Ni(OH)2、Mg(OH)2共沉淀的混合体系中,若c(Ni2+)=5.5×10-11mol·L-1,则c(Mg2+)=________。
(4)假定步骤①中NaClO恰好反应,欲检验滤液3中的酸根离子,需优先检验________(填离子符号)。
(5)为测定该矿样中铁元素的含量,取20.0 g矿石,按上述流程操作,将________(填“滤渣1”、“滤渣2”或“滤渣3”)完全酸溶,再使其中的铁元素还原为Fe2+,然后将所得溶液稀释到100 mL,取出20.00 mL用0.100 0 mol·L-1KMnO4溶液滴定。达到滴定终点时溶液颜色为________色,共消耗KMnO4溶液16. 00 mL,经计算矿样中铁元素的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组做乙醛和新制氢氧化铜的反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
乙醛溶液进行下列实验.
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
(1)上表中a、b应为(填字母序号)。___________________
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是___________。
(4)由实验4可以得出结论:当NaOH的用量较大时,新制氢氧化铜可以与乙醛发生反应,生成Cu2O红色沉淀。该反应的化学方程式为_________。
(5)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是_______________。
(6)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是__________________基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性氧化锌用作橡胶硫化的活性剂、补强剂。以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如下:
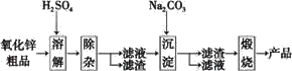
一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:

(1)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是_____。
(2)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,还含有Fe2+、Cu2+等杂质。先加入____(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009mol·L-1,则每升溶液中至少应加入__molKMnO4。
(3)杂质Cu2+可利用置换反应除去,应选择的物质是_____。
(4)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450℃~500℃下进行,“煅烧”反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用已知浓度的盐酸来测定某氢氧化钠样品的纯度(杂志不参与反应),试根据实验回答下列问题:
(1)准确称量5.0 g含有少量易溶杂质的样品,配成1L待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.100 0 mol·L-1的盐酸来滴定待测溶液,可选用________作指示剂。
A.甲基橙 B.石蕊 C.酚酞
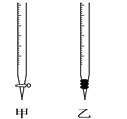
(3)滴定过程中氢氧化钠溶液放在锥形瓶中,则盐酸应该放在_______(填“甲”或“乙”)中。该同学选用酚酞做指示剂,如何判断达到滴定终点:_______________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是______________ mol·L-1,烧碱样品的纯度是_______________。
滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 10.50 |
第二次 | 10.00 | 4.10 | 14.00 |
第三次 | 10.00 | 2.50 | 14.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
①观察酸式滴定管液面时,开始平视,滴定终点俯视,则滴定结果______________。
②滴定前酸式滴定管尖嘴处有气泡,滴定后气泡消失,则滴定结果______________。
③洗涤后锥形瓶未干燥,则滴定结果______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1 mol/L的NH4HCO3溶液,pH =7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是
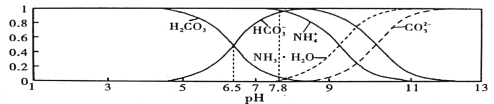
A. 常温下Kb(NH3·H2O)> Kal(H2CO3)
B. 向pH =6.5的上述溶液中逐滴滴加NaOH溶液时,NH4+和HCO3一浓度都逐渐减小
C. NH4HCO3溶液中存在下列守恒关系:c( NH4+) +c( NH3·H2O) =c(HCO3-)+c(CO3 2-)+c( H2 CO3)
D. 当溶液的pH =9时,溶液中存在下列关系:c(HCO3-)>c(NH4+>c(NH3·H2O)>c(CO3 2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K、1.01×105Pa下,将22gCO2通入750mL1molL-1NaOH溶液中充分反应,测得反应放出xkJ的热量。已知该条件下,将1molCO2通入1L2molL-1NaOH溶液中充分反应放出ykJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x)kJmol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y)kJmol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y)kJmol-1
D.2CO2(g)+2NaOH(aq)=2NaHCO3(aq) ΔH=-(4x-2y)kJmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com