
 煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.
煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.| 时间/min | 0 | 1 | 3 | 8 | 11 |
| n(H2)mol | 8 | 6 | 3 | 2 | 2 |
分析 (1)臭氧是理想的烟气脱硝试剂,已知:
①4NO2(g)+O2(g)?2N2O5(g)△H=-56.70kJ•mol-1
②3O2(g)?2O3(g)△H=+28.80kJ•mol-1
目标反应的反应热△H,2NO2(g)+O3(g)?N2O5(g)+O2(g)的△H=$\frac{①-②}{2}$,由此分析解答;
(2)a.正反应是放热反应,所以升高温度,平衡常数减小;
b.增大O3量,平衡正向移动,可以提高NO2转化率;
c.降低温度,化学反应速率减慢;
d.t1时反应速率加快,所以使用了催化剂;
(3)根据v=$\frac{△c}{△t}$,平衡常数K等于平衡时生成物的浓度的幂之积比上反应物浓度幂之积;其他条件不变,将12molCO2和16molH2充入密闭容器中反应,相当于增大压强;
(4)在相同温度下,根据k=Ae(-Ea/Rr),活化能Ea越大,K越小;
(5)电解过程中阴极发生还原反应,电极反应式为:3CO2+4e-=C+CO32-.
解答 解:(1)臭氧是理想的烟气脱硝试剂,已知:
①4NO2(g)+O2(g)?2N2O5(g)△H=-56.70kJ•mol-1
②3O2(g)?2O3(g)△H=+28.80kJ•mol-1
目标反应的反应热△H,2NO2(g)+O3(g)?N2O5(g)+O2(g)的△H=$\frac{①-②}{2}$=$\frac{-56.70-28.80}{2}$=-42.75kJ•mol-1,故答案为:-42.75kJ•mol-1;
(2)a.正反应是放热反应,所以升高温度,平衡常数减小,故正确;
b.增大O3量,平衡正向移动,可以提高NO2转化率,故正确;
c.降低温度,化学反应速率减慢,故错误;
d.t1时反应速率加快,所以使用了催化剂,故正确;
故选abd;
(3)v(H2)=$\frac{△c}{△t}$=$\frac{\frac{8-2}{2}}{8}$=0.375mol•L-1•min-1;所以v(CH3OH)=$\frac{0.375mol•{L}^{-1}•mi{n}^{-1}}{3}$=0.125mol•L-1•min-1;
CO2(g)+3H2(g)?CH3OH(g)+H20
初起浓度:3 4 0 0
变化浓度:1 3 1 1
平衡浓度:2 1 1 1
K=$\frac{1×1}{{1}^{3}×2}$=0.5,其他条件不变,将12molCO2和16molH2充入密闭容器中反应,相当于增大压强,平衡正向移动,H2是转化率会增大,故答案为:0.125;0.5;增大;
(4)在相同温度下,根据k=Ae(-Ea/Rr),活化能Ea越大,K越小,所以活化能Ea越大,化学反应速率常数k越小,故答案为:越小;
(5)电解过程中阴极发生还原反应,电极反应式为:3CO2+4e-=C+CO32-,故答案为:3CO2+4e-=C+CO32-.
点评 本题考查反应速率计算、化学平衡的计算与影响因素、平衡常数等,难度中等,注意基础知识的掌握,注意(3)中三行式的应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 (具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:回答下列问题:
(具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:回答下列问题: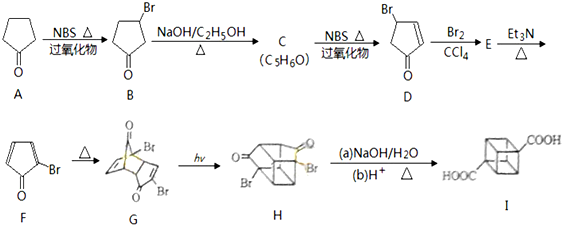
 ,E的结构简式为
,E的结构简式为 .
.
 :反应3可用的试剂为O2/Cu.
:反应3可用的试剂为O2/Cu.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
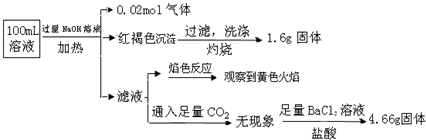
| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| C. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| D. | 取少量原溶液于试管中,加入KSCN溶液,溶液成血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
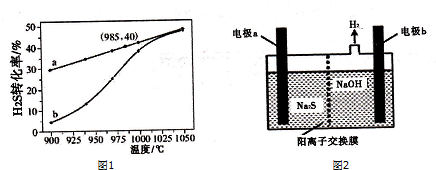
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
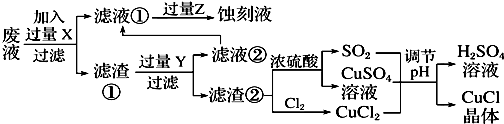
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com