
 图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极.接通电路后,发现B上的c点为红色.试回答:
图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极.接通电路后,发现B上的c点为红色.试回答:分析 A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,发现c点显红色,则c点发生2H++2e-=H2↑,所以c为阴极,电源上b为负极,C中发生2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,f上生成氢气,硫酸浓度变大,pH减小,以此来解答.
解答 解:(1)发现c点显红色,则c点发生2H++2e-=H2↑,所以c为阴极,电源上b为负极,故答案为:负;
(2)c为阴极,电解氯化钠溶液时c点发生2H++2e-=H2↑,e为阳极,电解硫酸溶液相对于电解水,e电极反应式为4OH--4e-=2H2O+O2↑,
故答案为:2H++2e-=H2↑;4OH--4e-=2H2O+O2↑;
(3)c、d、e、f 各极的电极反应式分别为2H++2e-=H2↑,2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑,2H++2e-=H2↑,据电子守恒可知,各极的电解产物的物质的量之比为2﹕2﹕1﹕2,故答案为:2﹕2﹕1﹕2.
点评 本题考查电解原理,明确c点显红色是解答本题的突破口,熟悉发生的电极反应即可解答,题目难度不大.


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ls22s22p63s23p5 | B. | 1s22s22p63s23p2 | C. | 1s22s22p2 | D. | 1s22s22p63s23p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物. .
. 、
、 .
. ,试写出有关化学反应方程式:CH≡CH+HCl$→_{△}^{催化剂}$CH2=CHCl,nCH2=CHCl$\stackrel{一定条件}{→}$
,试写出有关化学反应方程式:CH≡CH+HCl$→_{△}^{催化剂}$CH2=CHCl,nCH2=CHCl$\stackrel{一定条件}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等n的水与重水含有的中子数 | |
| B. | 等n的铁分别与足量氯气和硫完全反应时转移的电子数 | |
| C. | 等m的乙烯和丙烯中含有的共用电子对数 | |
| D. | 同温、同压同体积的CO和NO含有的质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
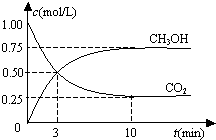 恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:
恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:| A. | 该密闭容器的体积为1 L | |
| B. | 反应达平衡,氢气的转化率为0.75 | |
| C. | 反应达平衡,氢气平均反应速率0.075 mol/(L•min) | |
| D. | CO2或H2O物质的量不再改变时反应达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4•10H2O脱水是吸热过程 | |
| B. | 较长时间制冷是由于Na2SO4•10H2O脱水是较慢的过程 | |
| C. | 铵盐在该条件下,发生的复分解反应是吸热反应 | |
| D. | NH4NO3溶于水会吸收热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com