
 I.下表是A、B、C、D、E五种短周期元素的某些性质:
I.下表是A、B、C、D、E五种短周期元素的某些性质:| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| X | Y | Z | |
| 第一电离能/(kJ/mol) | 520.2 | 495.8 | 418.8 |
分析 I.A、B、C、D、E五种短周期元素,B、D化合价均为-2价,处于VIA则,电负性D>B,则D为O元素、B为S元素;A的化合价为-4,处于IVA族,电负性等于S的,则A为碳元素;C、E化合价均为-1,属于ⅡA族元素,电负性C<E,则C为Cl、E为F元素;
Ⅱ.(4)X、Y、Z的价层电子构型为ns1,处于IA族,第一电离能X>Y>Z,则原子序数X<Y<Z,其氯化物均为离子晶体,离子所带电荷相等,离子半径越小,晶格能越大,熔点越高;
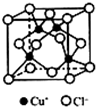
(5)晶胞中Cl-离子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Cu+离子数目为4,二者数目之比为1:1,则配离子数目之比为1:1;计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:I.A、B、C、D、E五种短周期元素,B、D化合价均为-2价,处于VIA则,电负性D>B,则D为O元素、B为S元素;A的化合价为-4,处于IVA族,电负性等于S的,则A为碳元素;C、E化合价均为-1,属于ⅡA族元素,电负性C<E,则C为Cl、E为F元素,
(1)E为F元素,原子的外围电子排布式为2s22p5,故答案为:2s22p5;
(2)与CO2互为等电子体的分子化学式为N2O等,故答案为:N2O;
(3)SO2分子中S原子孤电子对数=$\frac{6-2×2}{2}$=1,价层电子对数为2+1=3,则S原子杂化方式为sp2杂化,分子的立体构型为:V形,
故答案为:sp2;V形;
Ⅱ.(4)X、Y、Z的价层电子构型为ns1,处于IA族,第一电离能X>Y>Z,则原子序数X<Y<Z,其氯化物均为离子晶体,离子所带电荷相等,离子半径:X<Y<Z,故晶格能XCl>YCl>ZCl,故熔点:ZCl<YCl<XCl,
故答案为:ZCl<YCl<XCl;
(5)晶胞中Cl-离子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Cu+离子数目为4,二者数目之比为1:1,则配离子数目之比为1:1,与同一个Cu+相连的Cl-有4个,则与同一个Cl-相连的Cu+有4个;
晶胞质量为4×$\frac{64+35.5}{{N}_{A}}$g,则晶胞密度=4×$\frac{64+35.5}{{N}_{A}}$g÷(a cm)3=$\frac{398}{{N}_{A}×{a}^{3}}$g•cm-3,
故答案为:4;$\frac{398}{{N}_{A}×{a}^{3}}$g•cm-3.
点评 本题是对物质结构与性质的考查,涉及元素周期律、核外电子排布、等电子体、杂化方式与空间构型判断、电负性、电离能、晶体类型与性质、晶胞结构与计算等,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
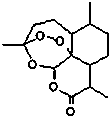 东晋医药学家葛洪的《肘后备急方•治寒热诸疟方》记载有“青蒿一握,以水二升渍,绞取汁,尽服之”的说法,说明不能加热青蒿,因高温可能使活性成分受损.中国药学家屠呦呦用沸点只有35℃的乙醚作为溶剂来提取青蒿素,创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.已知青蒿素的结构如图所示,下列有关青蒿素的说法,不正确的是( )
东晋医药学家葛洪的《肘后备急方•治寒热诸疟方》记载有“青蒿一握,以水二升渍,绞取汁,尽服之”的说法,说明不能加热青蒿,因高温可能使活性成分受损.中国药学家屠呦呦用沸点只有35℃的乙醚作为溶剂来提取青蒿素,创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.已知青蒿素的结构如图所示,下列有关青蒿素的说法,不正确的是( )| A. | 分子式为C15H22O5 | |
| B. | 能够发生水解反应 | |
| C. | 用沸点只有35℃的乙醚作为溶剂来提取青蒿素的方法化学上叫萃取 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键或酯基等基团有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
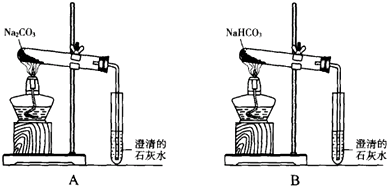
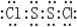 .Y2 Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl
.Y2 Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室配制一定物质的量浓度NaCl溶液,用托盘天平秤取5.85gNaCl | |
| B. | 用容量瓶配制溶液时先将容量瓶洗涤并烘干 | |
| C. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| D. | 酸碱滴定时当指示剂变色后保持半分钟内不变色即达滴定终点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
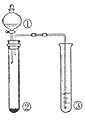 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | Na2S | CuSO4 | 酸性:H2S>H2SO4 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从碘水中萃取碘单质,可用苯做萃取剂 | |
| B. | 用加热分解的方法可以区别碳酸钠和碳酸氢钠两种固体 | |
| C. | 配制一定物质的量浓度的NaCl溶液时,只需使用1次玻璃棒 | |
| D. | 氨气喷泉实验时,烧瓶必须干燥才可收集 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com