
| 甲 | 乙 | 丙 | 丁 |
化合物中各元素原子个数比 | A∶C=1∶1 | B∶A=1∶2 | D∶E=1∶3 | B∶E=1∶4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E的邻族元素,化学性质活泼;D和E则位于同周期,且D和E的原子序数之和为30。
(1)D和E同属于哪一周期元素?推断依据是什么?
(2)根据题目提供的条件,推断E在周期表中的族序数所必要的条件是什么?
(3)向甲的水溶液中加入MnO2,反应的化学方程式是____________________________。
(4)已知乙的相对分子质量小于甲。写出实验室制取乙的化学方程式:__________________。
(5)丙的水溶液呈酸性,与饱和NaHCO3溶液反应,会迅速产生大量气体和难溶物,有关离子方程式是_______________________________________。
(6)向 3 mL 1 mol·L-1 KI溶液中依次注入下列试剂:①1 mL 5 mol·L-1盐酸;②0.5 mL 30%甲溶液;③1 mL 丁,经充分振荡后,静止,可得一紫色溶液。这种紫色溶液是_________。
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010年河北省正定中学高三下学期第二次考试(理综)化学部分 题型:填空题
(14分)有原子序数依次增大的五种主族元素X、Y、Z、W、R,已知:①X与Z,Y、R与W分别同族;②X、Z、W分别与Y都可组成两种中学常见的化合物;③Y的阴离子与Z的阳离子的核外电子排布相同。根据以上叙述回答问题:
(1)R单质可用作半导体材料,写出该元素名称 它与Y元素原子序数差为_____
(2)用电子式表示化合物X2W的形成过程__________________________________。
(3)写出2种均由X、Y、Z、W 4种元素所组成的化合物在水溶液中发生反应的化学方程式_________________。Z、X、W三种元素组成的盐溶于水呈碱性,溶液中离子浓度大小顺序为:______________________________。
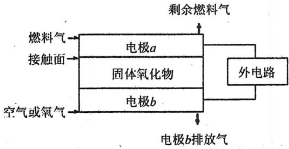
(4)X、Y两元素的单质已被应用于宇宙飞船的燃料电池,其结构如图所示。两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出在电极表面放电。b电极上的电极反应式为_______。
(5)请写出Z元素单质的一种用途_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com