
| A. | 1 L该溶液中含有NaOH 4.0 g | |
| B. | 给NaOH溶液通电,使NaOH发生电离 | |
| C. | NaOH的电离方程式是:NaOH═Na++OH- | |
| D. | NaOH溶液能导电,是因为溶液中有自由移动的Na+、OH-离子 |
分析 A.根据n=cV计算氢氧化钠物质的量,再根据m=nM计算其质量;
B.氢氧化钠的电离,是在水中,不需要通电;
C.氢氧化钠是强电解质,属于强碱,能完全电离出钠离子和氢氧根离子;
D.溶液导电的原因是溶液中存在自由移动离子.
解答 解:A.0.1L溶液中氢氧化钠物质的量为0.1L×0.1mol/L=0.01mol,其质量为0.01mol×40g/mol=0.4g,故A正确;
B.氢氧化钠在水溶液中能发生电离,条件不是通电,故B错误;
C.氢氧化钠完全电离出钠离子和氢氧根离子,故C正确;
D.氢氧化钠能导电,是由于氢氧化钠在水中电离出钠离子和氢氧根离子,故D正确,
故选B.
点评 本题主要考查的是氢氧化钠溶液的概念以及氢氧化钠的电离,本题难度不大,掌握物质的量的有关公式是关键.


科目:高中化学 来源: 题型:解答题

| 操作 | 现象 | |
| 甲 | 向Ⅰ中加入必要的试剂,并向Ⅳ中加入KI、淀粉溶液.连接Ⅰ、Ⅳ,打开活塞 | Ⅰ中剧烈反应,产生无色气体并伴随大量白雾;Ⅳ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入必要的试剂,并向Ⅳ中加入KI、淀粉溶液和稀硫酸.连接Ⅱ、Ⅳ,点燃酒精灯 | Ⅳ中有气泡冒出,溶液变蓝 |
| 操作 | 现象 | |
| 丙 | 向Ⅰ中加入Na2CO3和稀硫酸,Ⅳ中加入KI、淀粉溶液并在上层覆盖少量煤油.使Ⅰ中发生反应将装置中空气排尽后,再将气体通入Ⅳ的溶液中 | Ⅳ中有气泡冒出,溶液不变蓝 |
| 丁 | 向Ⅰ中加入Na2CO3和稀硫酸,Ⅲ中加入必要试剂,Ⅳ中加入KI、淀粉溶液.依次连接Ⅰ、Ⅲ、Ⅳ,打开活塞 | Ⅳ中有气泡冒出,溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

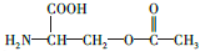 .
. b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 112 mL | B. | 224 mL | C. | 448 mL | D. | 560 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
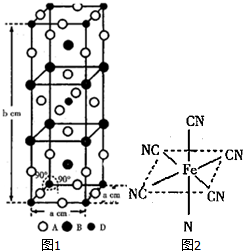
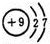
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是分散质的微粒直径在1nm~100nm之间 | |
| B. | 用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体 | |
| D. | 胶体是一种介稳性的分散系,其粒子能通过滤纸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com