
下列溶液一定显酸性的是( )
A.溶液中[OH-]>[H+]
B.滴加紫色石蕊试液后变红色的溶液
C.溶液中[H+]=10-6 mol·L-1
D.pH<7的溶液
科目:高中化学 来源: 题型:
向Fe2O3、CuO、Fe、Cu的混和粉末中加入过量的稀盐酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是()
A. 只有Fe2+和Cu2+
B. 一定有Fe2+、Cu2+,可能有Fe3+
C. 一定有Fe2+,可能有Cu2+
D. 只有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O  4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH= 的溶液。
(2)高铁酸钾有以下几种常见制备方法:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式: 。
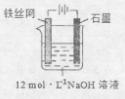
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为 ,正极反应为: 。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L,含有2.0×l0-4 mol·L-l K2FeO4的废水中有CaFeO4沉淀产生,理论上至少加入Ca(OH)2的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,这个反应的正反应速率和逆反应速率相等
C.可以通过控制反应条件,使2 mol SO2与1 mol O2反应生成2 mol SO3
D.化学反应的限度可以通过改变反应条件来改变
查看答案和解析>>
科目:高中化学 来源: 题型:
在某温度时将2 mol A和1 mol B两种气体通入容积为2 L的密闭容器中,发生如下反应:2A(g)+B(g)x C(g),2 min时反应达到平衡状态,经测定B的物质的量为0.4 mol,C的反应速率为0.45 mol·L-1·min-1。下列各项能表明该反应达到平衡的是( )
A.vA(正):vB(逆)=2:1
B.C的物质的量为1.2 mol
C.混合气体的压强不再变化
D.混合气体的总质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃的下列溶液中,碱性最强的是( )
A.pH=11的溶液
B.[OH-]=0.12 mol·L-1
C.1 L中含有4 g NaOH的溶液
D.[H+]=1×10-10 mol·L-1的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为10 mL一定物质的量浓度的HCl溶液用一定物质的量浓度的NaOH溶液滴定的图示。请根据图示计算:
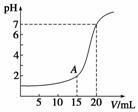
(1)氢氧化钠溶液物质的量浓度是多少?
(2)A点时溶液的pH是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2(g)+Br2(l)═2HBr(g);△H=﹣72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时 需要吸收的能量/KJ | 436 | a | 369 |
则表中a为( )
|
| A. | 404 | B. | 260 | C. | 230 | D. | 200 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比KMnO4更强,本身在反应中被还原为Fe3+生成Fe(OH)3,达到净水目的,它是由Fe(NO3)3,NaOH和Cl2在一定条件下制得:
2Fe(NO3)3+16NaOH+3Cl2→□Na2FeO4+□NaNO3+□ +□H2O
(1)在横线上填上适当的物质,使制备Na2FeO4反应原理完整,并用双线桥法表示出点子转移的方向和数目 .
(2)反应使用的Fe(NO3)3可以用Fe粉和稀HNO3反应制(提示:反应过程中HNO3只被还原成NO),现在要制备Na2FeO483g的问:需要Fe粉 克,HNO3 克?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com