
| A. | 锥形瓶用蒸馏水洗涤后,用待测HCl溶液润洗 | |
| B. | 滴定管用蒸馏水洗涤后,直接装入NaOH溶液进行滴定 | |
| C. | 滴定时,没有逐出滴定管下口的气泡 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持相平 |
分析 A.锥形瓶不能润洗,否则会导致待测液中氯化氢的物质的量偏大;
B.滴定管必须润洗,否则会导致标准液浓度减小,测定结果偏高;
C.滴定管中有气泡,影响了标准液体积;
D.读数时,视线应该与滴定管内凹液面最低处相平.
解答 解:A.锥形瓶用蒸馏水洗涤后,不能润洗,如果用待测HCl溶液润洗后,滴定过程中导致消耗标准液体积偏大,测定结果偏高,故A错误;
B.滴定管用蒸馏水洗涤后,直接装入NaOH溶液进行滴定,导致标准液被稀释,则滴定过程中消耗标准液体积偏大,测定结果偏高,故B错误;
C.滴定时必须赶出滴定管中气泡,否则会影响测定结果,故C错误;
D.读数时,视线应该与滴定管内液体的凹液面最低处保持相平,该操作方法合理,故D正确;
故选D.
点评 本题考查了中和滴定的操作方法,题目难度不大,明确中和滴定操作方法为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题



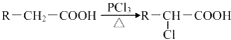

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 点①所示溶液中:2c(CH3COO-)-2c(CH3COOH)=c(H+)-c(OH-) | |
| B. | 点②所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 点③所示溶液中:c(CH3COO-)-c(CH3COOH)=c(Na+)+2c(H+)-2c(OH-) | |
| D. | pH=12的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)>c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管在装酸液前用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 | |
| D. | 盛NaOH溶液的锥形瓶滴定前未用NaOH溶液润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者相等 | B. | 前者比后者大11倍 | ||
| C. | 后者是前者的108倍 | D. | 后者是前者的1011倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| 1.将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色. |
| 2.向新制得的Na2S溶液中滴加少量新制的氯水 | B.有气体产生,溶液变成浅红色 |
| 3.将一小块钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| 4.将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| 5.将铝条投入稀盐酸中 | E.生成淡黄色沉淀 |
| 实验内容 | 实验现象 | 离子方程式 |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 |
| 实验 序号 | 氯化镁固体中氯元素含量/% | 温度/℃ | 粉碎方式/ | 催化效果/g•g-1 |
| 1 | 70.97 | 20 | 滚动球磨 | 3.9×104 |
| 2 | 74.45 | 20 | 滚动球磨 | 5.0×104 |
| 3 | 74.45 | 20 | 振动球磨 | 5.9×104 |
| 4 | ω | 100 | 振动球磨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
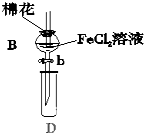 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:| 过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com