
| A、已知2H2(g+O2(g)=2H2O(g)△H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol |
| B、稀氢氧化钠溶液与稀盐酸溶液中和,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol |
| C、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D、需要加热才能发生的反应不一定是吸热反应 |


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
| A、由水电离的c(H+)=10-12mol?L-1的溶液中:Cl-、CO32-、K+、SO32- |
| B、含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3- |
| C、1.0mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| D、使pH试纸变深蓝色的溶液中:Cl-、K+、Mg2+、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 7.540 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.6720 | 1.344 | 2.688 |
| 硫的质量/g | 0.8000 | 1.600 | 3.200 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉溶液(葡萄糖):渗析 |
| B、乙醇(乙酸):加KOH溶液,分液 |
| C、甲醇溶液(甲酸):加NaOH溶液,蒸馏 |
| D、肥皂液(甘油):加食盐搅拌、盐析、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 平行实验编号 | Na2C2O4质量 (m g) | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
| 1 | 1.34 | 0.00 | 25.02 |
| 2 | 1.34 | 0.02 | 25.00 |
| 3 | 1.34 | 0.18 | 25.18 |
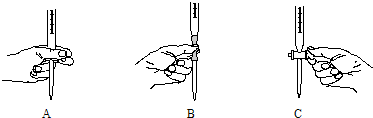
查看答案和解析>>
科目:高中化学 来源: 题型:
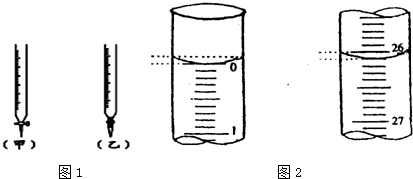
| 锥形瓶中溶液 | 滴定管中溶液 | 指示剂 | 滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,冷却水应从冷凝器下端进入 |
| C、蒸发时,要用玻璃棒不断搅动溶液 |
| D、过滤时,将待过滤的液体直接倒入漏斗,使液面低于滤纸的边缘 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com