
| ||
| 高温高压 |
| ||
| 高温高压 |


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
| A、化学反应速率:乙>甲 |
| B、平衡后N2的浓度:乙>甲 |
| C、H2的转化率:乙>甲 |
| D、平衡混合气中H2的体积分数:乙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ||||||||
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
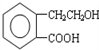 ,可通过它用不同化学反应分别制得B、C和D 三种物质.
,可通过它用不同化学反应分别制得B、C和D 三种物质.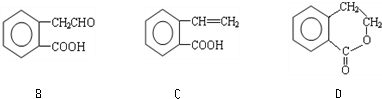
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Na2O2与H2O反应:2O
| ||
B、FeCl3溶液与Cu反应:Fe3++Cu=Fe2++Cu
| ||
| C、CaCO3与醋酸溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O | ||
D、KAl(SO4)2溶液与氨水反应:Al3++3NH3?H2O=Al(OH)3↓+3NH
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com