
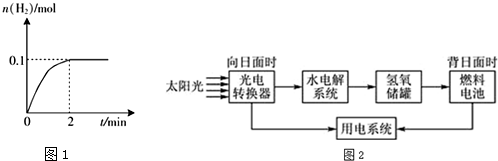
分析 (1)a.硫酸常温下,不易分解.
b.反应中二氧化硫表现还原性,SO2还原性比HI强.
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O.
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2.
(2)由图可知,2min内H2物质的量的变化量,然后计算化学反应速率,再利用化学反应速率之比等于化学计量数之比来解答;根据反应方程式写平衡表达式,结合平衡浓度计算平衡常数,化学方程式改变方向,平衡常数互为倒数;利用浓度对化学平衡的影响来分析HI的平衡浓度、达到平衡的时间、平衡时H2的体积分数,但温度不变,平衡常数不变;
(3)①光电转换器的能量转换形式为太阳能转化成电能;
②Na2SO4在水中电离生成钠离子和硫酸根离子;
③燃料电池放电时的负极发生氧化反应.
解答 解:(1)a.硫酸常温下稳定,不易分解,故a错误;
b.反应中二氧化硫表现还原性,还原性比HI强,故b正确;
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故c正确;
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2,即循环过程中产生l mol O2的同时产生2mol H2,故d错误;
故答案为:bc;
(2)由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为$\frac{0.1mol}{2L}$=0.05mol/L,用氢气表示的化学反应速率为$\frac{0.05mol/L}{2min}$=0.025mol/(L.min),由反应中的化学计量数可知v(HI)=0.025mol/(L.min)×2=0.05mol/(L.min);根据方程式计算平衡浓度,c(H2)=0.05mol/L,c(I2)=0.05mol/L,c(HI)=0.4mol/L,K=$\frac{c({H}_{2})×c({I}_{2})}{c(HI)}$=$\frac{0.05×0.05}{0.{4}^{2}}$=$\frac{1}{64}$mol•L-1•min-1,对该反应,当温度不变开始加入HI(g)的物质的量是原来的2倍,则温度不变,K不变,故a错;物质的量为原来的2倍,该反应是反应前后气体体积相等的反应,则反应体系中各物质的浓度都是原来的2倍,故b正确;物质的量增大,则化学反应速率先增大的快,后随浓度的减小,速率增大的程度变小,故c错;
由反应方程式及原来的量与后来的量成正比,则这两种情况下建立的平衡为等效平衡,即平衡时H2的体积分数相同,故d错;
故答案为:0.05mol•L-1•min-1;$\frac{1}{64}$;b;
(3)①光电转换器的能量转换形式为太阳能转化成电能,
故答案为:太阳能转化成电能;
②Na2SO4在水中电离生成钠离子和硫酸根离子,所以加入Na2SO4的目的是增强溶液的导电性,
故答案为:增强溶液的导电性;
③燃料电池放电时的负极发生氧化反应,在碱性环境下,反应式为2OH-+H2-2e-=2H2O,
故答案为:2OH-+H2-2e-=2H2O.
点评 本题主要考查的知识点较多,主要是化学反应速率、平衡常数计算、能量转化形式、原电池等综合性较强,题目难度中等,需要平时对化学平衡、电化学知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 传统的节日和纪念日,从中央到地方都应该多举办形式华丽、场面壮观的大型庆典活动,贫困地区可以靠拉赞助、贷款、摊派等形式筹集相关费用 | |
| B. | 不囤东西,不买便宜次品货,确有必要的东西,买好的,并充分使用它 | |
| C. | 精简银行卡,仅保留一张借记卡一张信用卡 | |
| D. | 用电脑写东西,少用纸,养成纸质文件扫描、存档的习惯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
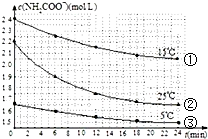 已知氨基甲酸铵发生的水解反应为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,某研究小组得到c(NH2COO-)随时间变化曲线如图所示.下列有关说法一定正确的是( )
已知氨基甲酸铵发生的水解反应为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,某研究小组得到c(NH2COO-)随时间变化曲线如图所示.下列有关说法一定正确的是( )| A. | 对比①与③,可知浓度越大水解速率越快 | |
| B. | 对比①与②,可知温度越高水解速率越快 | |
| C. | 加水稀释,平衡向正反应方向移动,K值增大 | |
| D. | 氨基甲酸铵在碱性条件下比在酸性条件下水解程度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
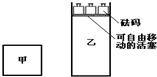 一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g)△H<0.现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图).关于两容器中反应的说法正确的是( )
一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g)△H<0.现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图).关于两容器中反应的说法正确的是( )| A. | 两容器达平衡后升高相同的温度时,甲容器的反应速率大于乙容器的速率 | |
| B. | 两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的密度不同 | |
| C. | 甲容器中的反应先达到化学平衡状态 | |
| D. | 在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的物质的量是乙中物质C的物质的量的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 稀盐酸滴在石灰石上:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠和稀硫酸反应:HCO3-+H+═CO2↑+H2O | |
| D. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com