
【题目】(I)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。
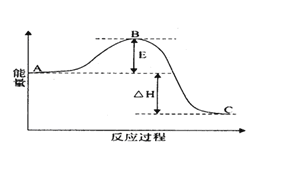
已知1molSO2(g)氧化为1molSO3(g)的△H=-99kJmol-1.请回答下列问题:
(1)E的大小对该反应的反应热______(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点______(填“升高”还是“降低”)。
(2)完成SO2氧化为SO3的热化学方程式______________________。
(II)用 50mL0.50mol/L 盐酸与 50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
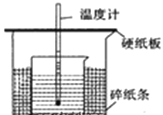
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。实验中能否用环形铜丝搅拌棒代替该用品_______(填“能”或“否”)
(2)向盐酸溶液中加入NaOH溶液的正确操作是_______(从下列选出)。
A.沿玻璃棒缓慢倒入 B. —次迅速倒入 C.分三次少量倒入
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会_____(填“偏大”、“偏小”、“无影响”)。
(4)小明利用上述装置做实验,测得中和热的数值偏低,请你分析可能的原因是__________________。
A.测量完盐酸的温度再次测最NaOH溶液温度时,温度计上残留的酸液未用水冲洗干净。
B.做本实验的当天室温较高 C.大小烧杯口不平齐,小烧杯口未接触硬纸板。
D.在量取盐酸时仰视读数 E.大烧杯的盖板中间小孔太大
【答案】无降低2SO2(g)+O2(g) =2SO3(g) ΔH=-198kJ·mol-1环形玻璃搅拌棒否B偏小ACE
【解析】
(I)(1)反应热为正反应活化能与逆反应活化能的差值,因此活化能的大小与反应热无关;加入催化剂改变了反应的途径,降低反应所需的活化能,所以E的变化是减小,图中B点会降低;正确答案:无 ; 降低。
(2)因1molSO2(g)氧化为1molSO3(g)的△H=-99kJmol-1,所以2molSO2(g)氧化为2molSO3(g)的△H=-198kJmol-1,热化学方程式为:2SO2(g)+O2(g) =2SO3(g) ΔH=-198kJ·mol-1;正确答案:2SO2(g)+O2(g) =2SO3(g) ΔH=-198kJ·mol-1。
(II)(1)根据量热计的构造可以知道该装置的缺少仪器是环形玻璃搅拌棒;铜的导热性强,易造成热量的散失,所以实验中不能用环形铜丝搅拌棒代替环形玻璃搅拌棒;因此,本题正确答案是:环形玻璃搅拌棒,否。
(2)沿玻璃棒缓慢倒入或分多次把NaOH溶液倒人盛有盐酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,应一次迅速倒入;因此,本题正确答案是:B。
(3)一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替NaOH溶液反应,反应放出的热量偏小;因此,本题正确答案是:偏小。
(4)A.测量完盐酸的温度后,温度计没有用水冲洗干净,在测NaOH溶液温度时,会发生酸碱中和反应,温度计示数变化值减小,导致测得中和热的数值偏低,正确;
B.做本实验时的室温和反应热的数据之间无关,错误;
C.大小烧杯口不平齐,小烧杯口未接触硬纸板,会导致一部分能量的散失,导致测得中和热的数值偏低,正确;
D.在量取盐酸时仰视读数 ,会使得实际量取体积高于所要量的体积,酸过量,可以保证碱完全反应,导致测得中和热的数值偏高,错误;
E.大烧杯的盖板中间小孔太大,会导致一部分热量的散失,测得中和热的数值偏低,正确;
正确选项ACE。


科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C 表示10s内反应的平均反应速率为____________。
(2)反应前A的物质的量浓度是_______________。
(3)10s末,生成物D的浓度为______________________。
(4)A 平衡转化率______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)( )
|
|
|
|
A.实验室制取溴苯 | B.实验室制取乙酸乙酯 | C.石油分馏 | D.实验室制取硝基苯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丁香酚可作为合成香料的原料,其结构简式如下图所示。下列有关叙述正确的是( )
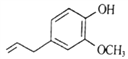
A. 异丁香酚属于芳香族化合物,分子式为C10H14O2
B. 该物质能使酸性高锰酸钾溶液褪色
C. 1mol该物质与足量H2发生加成反应,最多可消耗1molH2
D. 分子中所有原子有可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】180℃时将0.5 mol H2和1 mol CO2通入1 L的恒容密闭容器中,反应生成甲醇蒸汽(CH3OH)和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示,下列说法中正确的是

A. 该反应的化学方程式:2CO2+4H2![]() 2CH3OH+O2
2CH3OH+O2
B. 在0~3 min内H2的平均化学反应速率为0.1 mol·L-1·min-1
C. 当容器内混合气体密度不再变化时,表明反应已经达到平衡状态
D. 在3~10 min内,反应仍未达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要,广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。正极电极反应为__________。
(2)某学习小组依据氧化还原反应:2Ag++Cu===Cu2++2Ag设计成原电池,则负极发生的电极反应为 ________,当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移了的电子数目是_________。
(3)燃料电池是一种高效、环境友好的供电装置,如下图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①该电池的正极反应式__________________________。
②若该电池的效率80%,当外电路通过0.2mo1电子时,消耗O2的体积____L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是
千淘万漉虽辛苦,吹尽狂沙始到金 |
熬胆矾(CuSO4·5H2O) 铁釜,久之亦化为铜 |
凡石灰(CaCO3), 经火焚炼为用 |
丹砂(HgS)烧之成水银,积变又成丹砂 |
A | B | C | D |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离方程式:H2O![]() H++OH-。下列叙述中,正确的是
H++OH-。下列叙述中,正确的是
A. 升高温度,Kw增大,pH不变
B. 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C. 向水中加入少量硫酸,c(H+)增大,Kw不变
D. 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com