
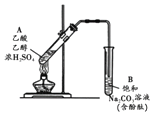
 某同学利用如图所示装置制备乙酸乙酯.实验如下:
某同学利用如图所示装置制备乙酸乙酯.实验如下:| A. | ①中加热利于加快酯化反应速率,故温度越高越好 | |
| B. | ③中油状液体层变薄主要是乙酸乙酯溶于Na2CO3溶液所致 | |
| C. | ③中红色褪去的原因可能是酚酞溶于乙酸乙酯中 | |
| D. | 取②中上层油状液体测其核磁共振氢谱,共有3组峰 |
分析 A.制取乙酸乙酯的原料易挥发,浓硫酸易氧化原料,乙酸乙酯(沸点77.2℃),温度越高,不利于乙酸乙酯的制备;
B.乙酸乙酯不溶于Na2CO3溶液;
C.③中下层红色溶液褪色,是碳酸钠反应掉挥发出来的乙酸;
D.取②中上层油状液体为乙酸乙酯,分子中有3种氢原子,核磁共振氢谱中有3种峰.
解答 解:A.①中加热利于加快酯化反应速率,但温度越高,制取乙酸乙酯的原料乙酸乙醇挥发更快,不利于提高转化率,乙酸乙酯(沸点77.2℃),温度越高,不利于乙酸乙酯收集到B中,故A错误;
B.饱和碳酸钠溶液能中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,③中油状液体层变薄,不是乙酸乙酯溶于Na2CO3溶液所致,故B错误;
C.碳酸钠溶液呈碱性,能使酚酞变红,停止加热,振荡试管,饱和碳酸钠溶液能中和挥发出来的乙酸,红色褪去,不是酚酞溶于乙酸乙酯中,故C错误;
D.取②中上层油状液体为乙酸乙酯,结构简式为:CH3COOCH2CH3,该分子的核磁共振氢谱中有三组峰,其峰面积之比是3:2:3,故D正确;
故选D.
点评 本题考查乙酸乙酯的制备,解答时须注意酯化反应的原理和饱和碳酸钠溶液的作用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 由现象所得结论 |
| A | 将Cl2通入品红溶液 | 品红褪色 | Cl2具有漂白性 |
| B | 向白色AgCl悬浊液中滴加0.1mol/LKI溶液 | 试管中白色沉淀转化为黄色沉淀. | Ksp(AgCl)>Ksp(AgI) |
| C | 将CO2通入CaCl2溶液中 | 无明显现象 | 非金属性:Cl>C |
| D | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/℃ | 700 | 800 | 830 | 1 000 |
| K | 0.6 | 0.9 | 1.0 | 1.7 |
| A. | 上述生成CO和H2O的反应为放热反应 | |
| B. | 加压、增大H2浓度和加入催化剂都能提高CO2的转化率 | |
| C. | 830℃达平衡后,再充入1.0 mol H2,K值增大,平衡正向移动 | |
| D. | 830℃时反应CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 工业上,向500℃左右的铁屑中通入Cl2生产无水氯化铁,其制备过程中均要确保无水.现模拟该过程用图示装置进行实验:
工业上,向500℃左右的铁屑中通入Cl2生产无水氯化铁,其制备过程中均要确保无水.现模拟该过程用图示装置进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | pH=5的下列溶液(①NH4Cl溶液②CH3COOH溶液;③稀盐酸)中由水电离出来的c(H+)水 ①>②>③ | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) | |
| D. | pH相同的下列三种溶液(①CH3COONa、②NaHCO3、③NaClO)中的c(Na+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为35、中子数为45的溴原子:3545Br | |
| B. | Al3+的结构示意图: | |
| C. | 羟基的电子式: | |
| D. | 乙醇的结构简式:C2H6O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com