
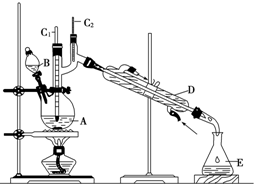
 某化学课外兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯.请分析后回答下列问题:
某化学课外兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯.请分析后回答下列问题: .
.分析 (1)根据苯与溴发生取代反应生成溴苯和溴化氢,从而写出方程式;
(2)反应产生的溴化氢气体遇到石蕊溶液,能石蕊溶液变红色,溴化氢气体通入硝酸银溶液,能产生浅黄色沉淀;
(3)由于苯和液溴都是易挥发的,所以三颈烧瓶右侧导管除导气外还起的作用是冷凝回流作用;
(4)溴化氢极易溶于水,容易发生倒吸;
(5)溴苯与水不互溶,可用分液的方法分开;溴苯与苯是互溶的液体,可用蒸馏的方法分开.
解答 解:(1)苯与溴发生取代反应生成溴苯和溴化氢,反应的方程式为 ,
,
故答案为: ;
;
(2)苯与溴发生取代反应生成溴苯和溴化氢,产生的溴化氢气体遇到石蕊溶液,能石蕊溶液变红色,溴化氢气体通入硝酸银溶液,能产生浅黄色沉淀,所以D试管内出现的现象为石蕊溶液变红,E试管内出现的现象为出现淡黄色沉淀,
故答案为:石蕊溶液变红;出现淡黄色沉淀;
(3)三颈烧瓶右侧导管特别长,除导气外还起的作用是冷凝回流;
故答案为:冷凝回流;
(4)在铁作催化剂的作用下,溴与苯反应生成溴苯、溴化氢,待三口烧瓶中的反应即将结束时(此时气体明显减少),打开F活塞,关闭C活塞,溴化氢通过F进入最左边集气瓶,溴化氢极易溶于水,产生倒吸现象;
故答案为:与F相连的广口瓶中NaOH溶液流入烧瓶;
(5)溴苯不溶于水,分液即可得到溴苯;溴苯与苯互溶,蒸馏即可得到溴苯;
故答案为:分液;蒸馏.
点评 该题是高考中的常见题型,属于中等难度的试题,试题综合性强,难易适中.在注重对学生基础性知识考查和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的严谨规范的实验设计能力,也有利于提高学生的学科素养.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2含有的分子数为NA | |
| B. | 标准状况下,80g SO3的体积为22.4L | |
| C. | 18g H2O在标准状况下的体积是22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
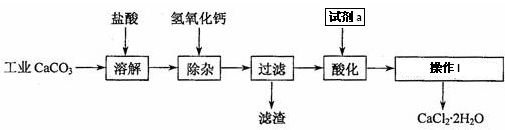
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 正丁醛是一种化工原料.某实验小组利用如右装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如右装置合成正丁醛.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高效利用CO2是“低碳经济”的有效途径,现有以下两种利用CO2的方法.
高效利用CO2是“低碳经济”的有效途径,现有以下两种利用CO2的方法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油、柴油、植物油都是碳氢化合物 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | 甲烷与氯气发生取代反应,乙烯与溴水发生加成反应 | |
| D. | 高锰酸钾可以氧化苯和乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com