
| A. | 在常温常压下,1mol氦气含有原子数为2NA | |
| B. | 0.5molO2和0.5molO3的混合物所含有的氧原子个数为2.5NA | |
| C. | 常温常压下,2.24 LCO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 |
分析 A.氦气是惰性气体,属于单原子分子;
B.0.5molO2中含1mol氧原子;0.5molO3中含1.5mol氧原子;
C.常温常压下气体摩尔体积大于22,4L/mol;
D.溶液的体积不等于水的体积.
解答 解:A.在常温常压下,氦气属于单原子分子,1mol氦气含有原子数为NA,故A错误;
B.0.5molO2中含1mol氧原子;0.5molO3中含1.5mol氧原子,故两者的混合物中含2.5mol氧原子即2.5NA个,故B正确;
C.常温常压下气体摩尔体积大于22,4L/mol,常温常压下,2.24 LCO和CO2混合气体物质的量小于 0.1mol,含有的碳原子数目小于0.1NA,故C错误;
D.溶液的体积不等于水的体积,所以含NA个Na+的Na2O溶解于1L水中形成溶液的体积不知道,无法计算其浓度,故D错误;
故选B.
点评 本题考查阿伏伽德罗常数,物质的量的有关计算,使用气体的摩尔体积时注意标准状况下的要求及物质所处的状态,题目难度不大.


科目:高中化学 来源: 题型:填空题
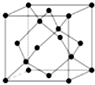 A、B、C、D、E、F为原子序数依次增大的六种元素,A的一种同位素可用于考古测定生物的死亡年代,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数是A、B之和的2倍;F的原子序数为29.回答下列问题:
A、B、C、D、E、F为原子序数依次增大的六种元素,A的一种同位素可用于考古测定生物的死亡年代,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数是A、B之和的2倍;F的原子序数为29.回答下列问题: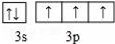 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,4.48LCHCl3的分子数为0.2 NA | |
| B. | 常温常压下,8gCH4含有5NA个电子 | |
| C. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1 NA | |
| D. | 28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
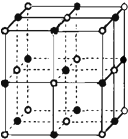 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 德国的维勒 | B. | 瑞典的贝采里乌斯 | ||
| C. | 德国的李比希 | D. | 匈牙利的海维西 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LH2O含有的分子数等于0.1NA | |
| B. | 0.5mol/L 的AlCl3溶液中含有的Al3+数为0.5 NA | |
| C. | 常温常压下16g O2中,氧原子数为NA | |
| D. | 1mol过氧化钠与水充分反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
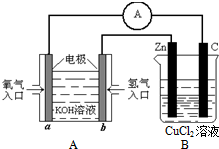 到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com