
| 103ρw |
| M |
| 15.8g |
| 158g/mol |
| 5 |
| 8 |
| 103ρw |
| M |
| 103×1.19×36.5% |
| 36.5 |
| 15.8g |
| 158g/mol |
| 16mol×0.1mol |
| 2mol |
| 5 |
| 8 |
| 5 |
| 8 |
| 112L×0.1mol |
| 2mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、①②⑥ | B、③⑤ |
| C、③④⑤⑥ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入纯Cu将Fe2+还原 |
| B、向溶液中加入(NH4)2S使Fe2+沉淀 |
| C、直接加水加热使杂质离子水解除去 |
| D、在溶液中通入Cl2,再加入CuO粉末调节pH为4-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯和甲苯都能与硝酸发生苯环上的取代反应 |
| B、苯和甲苯使酸性高锰酸钾溶液褪色 |
| C、苯和己炔都能使溴的四氯化碳溶液褪色 |
| D、苯和乙烷与卤素单质发生取代反应都需要铁作催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
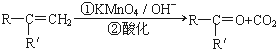 (R、R'可表示烃基或官能团)
(R、R'可表示烃基或官能团)
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com