
【题目】白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜可以发生如下两个反应:
(1)2P+5CuSO4+8H2O![]() 5Cu+2H3PO4+5H2SO4
5Cu+2H3PO4+5H2SO4
(2)11P+15CuSO4 +24H2O![]() 5Cu3P+6H3PO4+15H2SO4
5Cu3P+6H3PO4+15H2SO4
下列有关说法中错误的是( )
A. 上述两个反应中,水既不是氧化剂也不是还原剂
B. 上述两个反应中,氧化剂都只有硫酸铜
C. 上述两个反应中,氧化产物都是H3PO4
D. 反应(2)中,1molCuSO4可氧化1/5molP
【答案】B
【解析】
A. 上述两个反应中,水中各元素化合价均不变,所以水既不是氧化剂也不是还原剂,故A正确;
B. 2P+5CuSO4+8H2O![]() 5Cu+2H3PO4+5H2SO4反应中,氧化剂只有CuSO4;11P+15CuSO4 +24H2O
5Cu+2H3PO4+5H2SO4反应中,氧化剂只有CuSO4;11P+15CuSO4 +24H2O![]() 5Cu3P+6H3PO4+15H2SO4反应中,氧化剂是P、CuSO4,故B错误;
5Cu3P+6H3PO4+15H2SO4反应中,氧化剂是P、CuSO4,故B错误;
C. 上述两个反应中,都是P元素化合价升高,氧化产物都是H3PO4,故C正确;
D. 反应(2) 11P+15CuSO4 +24H2O![]() 5Cu3P+6H3PO4+15H2S中,15molCuSO4参加反应,铜离子得到15mol电子,所以15molCuSO4氧化3molP,当1molCuSO4可氧化1/5molP,故D正确。选B。
5Cu3P+6H3PO4+15H2S中,15molCuSO4参加反应,铜离子得到15mol电子,所以15molCuSO4氧化3molP,当1molCuSO4可氧化1/5molP,故D正确。选B。


科目:高中化学 来源: 题型:
【题目】下图所示是制取无水氯化铜的实验装置图,在A装置中将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中,烧瓶中发生反应的原理为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
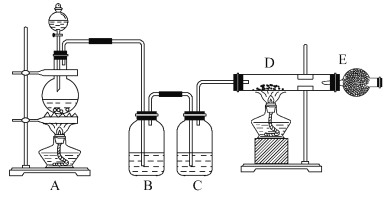
请回答下列问题:
(1)装置中盛放浓盐酸的仪器名称为_______。
(2)B瓶中试剂的作用是除去氯气中含有的氯化氢气体,C瓶中试剂的作用是______。
(3)玻璃管D中的反应方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分MnO2)粉碎后,与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
(1)Ⅰ中,粉碎软锰矿的目的是___________________。
(2)Ⅰ中,生成K2MnO4的化学方程式是______________________________。
(3)Ⅱ中,浸取时用稀KOH溶液的原因是_________________。
(4)Ⅲ中,CO2和K2MnO4在溶液中反应的化学方程式是_____________________。
(5)将K2MnO4溶液采用惰性电极隔膜法电解,也可制得KMnO4,装置如图:

①b极是______极(填“阳”或“阴”),D是_______________。
②结合电极反应式简述生成KMnO4的原理:_______________________________。
③传统无膜法电解时,锰元素利用率偏低,与之相比,用阳离子交换膜可以提高锰元素的利用率,其原因是______。
(6)用滴定法测定某高锰酸钾产品的纯度,步骤如下:
已知:Na2C2O4+H2SO4=H2C2O4+Na2SO4,5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,摩尔质量:Na2C2O4134gmol-1、KMnO4158gmol-1。
ⅰ.称取ag产品,配成50mL溶液。
ⅱ.称取bgNa2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
ⅲ.将锥形瓶中溶液加热到75℃~80℃,恒温,用ⅰ中所配溶液滴定至终点,消耗溶液VmL(杂质不参与反应)。
滴定终点的现象为_______________,产品中KMnO4的质量分数的表达式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题
(1)向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体的离子方程式为_______________________。
(2)Ca(OH)2的电离方程式为_______________。
(3)现有下列物质:①干冰②NaHCO3晶体③氨水④纯醋酸⑤FeCl3溶液⑥铜⑦蔗糖⑧熔化的NaCl,其中属于非电解质的是___________(填序号,下同),属于强电解质的有____________,属于弱电解质的有________________,能导电的物质有________________。
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀H2SO4至恰好完全反应。在此实验过程中,此实验中观察到的现象有___________________________________________。
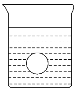
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的是( )
A.Na2CO3稀溶液中通入少量CO2:CO2+CO32-+H2O=2HCO![]()
B.向氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
C.大理石溶于盐酸:CaCO3+2HCl=Ca2++CO2↑+H2O+2Cl-
D.铁粉投入稀硝酸:Fe+2H+=Fe2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质所处的类别,以及是否具有氧化性或还原性能帮助我们认识其化学性质。
(1)请从下列试剂中选择合适的完成指定转化(试剂可以重复选择)。
试剂:盐酸、NaOH溶液、NaCl溶液、Na2SO4溶液、稀硝酸、FeSO4溶液
①P2O5(一种酸性氧化物)→Na3PO4的离子方程式:___;
②SO2→H2SO4的离子方程式:___;
③(NH4)2CO3→Na2CO3的离子方程式:___。
(2)根据如图所示物质的转化信息书写相应的反应方程式。
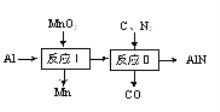
①“反应Ⅰ”的条件是高温,写出该反应的化学方程式:___;
②“反应Ⅱ”的条件是1700℃,写出该反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化银胶体中的分散质粒子实际上是一个个由很多“AgCl”结合而成的集合体,向盛有NaCl溶液的试管中滴加AgNO3溶液,静置后用一束光照射试管,发现试管的三个不同区域中只有一个区域具有明显的丁达尔现象,则下列分析正确的是

A.该区域是A,该区域中AgCl的直径最小
B.该区域是B,该区域中AgCl的直径介于A、C之间
C.该区域是C,该区域中AgCl的直径最大
D.各区域AgCl的大小相同,但只有B区域中分散质的大小介于1~100nm之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关说法正确的是
A. 60g冰醋酸晶体中,含阴离子数目为NA
B. 标准状况下,22.4LCCl4中含有分子的数目为NA
C. 常温下,46gNO2与N2O4混合气体中含分子数为NA
D. 32gCu投入300mL10mol/L的浓硝酸中,充分反应后转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用CH3CH2OH分两步制备1,2-二溴乙烷现用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
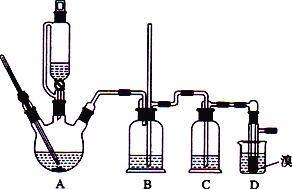
有关数据列表如下:
物质名称 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g·cm-3) | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置A中发生的化学方程式为_________________________________,反应类型为________,在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是________(填字母)。
a 引发反应 b减少副产物乙醚生成 c 防止乙醇挥发 d加快反应速率
(2)在装置C中应加入________(填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3) 装置D中实验现象为_______________。
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在________(填“上”或“下”)层。
(5)反应过程中应用冷水冷却装置D,其主要目的是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com