
【题目】下图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如下转化关系。(反应中生成的水已略去)
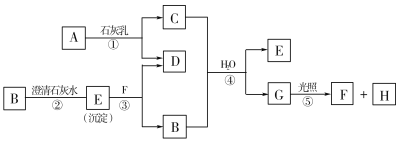
请回答以下问题:
(1)E是_____________,F是______________,H是_____________。(填化学式)
(2)C物质在日常生活中可作______________剂。
(3)写出反应①的化学方程式:_________________________。
【答案】CaCO3 HCl O2 消毒(或漂白) 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
【解析】
B可与澄清石灰水反应生成沉淀,应为CO2,则E为CaCO3,常见能与石灰水反应的气体还有氯气,则A应为Cl2,由此可以知道C为Ca(ClO)2,F为HCl,D为CaCl2,G为HClO,H为O2,结合对应物质的性质以及题目要求可解答该题。
B可与澄清石灰水反应生成沉淀,应为CO2,则E为CaCO3,常见能与石灰水反应的气体还有氯气,则A应为Cl2,由此可以知道C为Ca(ClO)2,F为HCl,D为CaCl2,G为HClO,H为O2;
(1) 由以上分析可以知道E为CaCO3,H为O2,F是HCl;
答案是:CaCO3 ;HCl;O2;
(2)C为Ca(ClO)2,可生成HClO,具有强氧化性和漂白性,可用于消毒或漂白;
答案是:消毒(或漂白);
(3)反应①的化学方程式为:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O;
故答案是:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。


科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有__________个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是__________,B原子的杂化轨道类型是_____。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_______(填元素符号),判断理由为_______________。
(2)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于____________。

(3)A原子的价电子排布式为3s23p5,铜与A 形成化合物的晶胞如图所示(黑点代表铜原子)。
①该晶体的化学式为______________。
②该化合物难溶于水但易溶于氨水,其原因是_____________ ,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为____________。
③己知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,己知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用。回答下列问题:
(1)Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为___,所含非金属元素的电负性由大到小的顺序为___。碳原子为____杂化,NO3-的空间构型为____。
(2)目前发现的铝原子簇Al13的性质与卤素相似,则原子簇Al13属于____晶体。Na[Al(OH)4]存在的化学键有 ___(填字母)。
A 离子键 B 极性键 C 非极性键 D 配位键 E 氢键 F 金属键
(3)已知:

反应后,当σ键增加了1 mol时,π键___(填“增加”或“减少”)了____个。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键”,可表示成π34,则![]() (咪唑)中的“离域兀键”可表示为_______
(咪唑)中的“离域兀键”可表示为_______
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子之间的距离为_____ pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,SO2和O2发生反应:2SO2(g)+O2(g)=== 2SO3(g),SO2的浓度随反应时间(t)的变化如下表。在0~10 s内,平均反应速率为( )
t/s | 0 | 5 | 10 | 15 |
SO2/(mol·L-1) | 0.82 | 0.40 | 0.32 | 0.28 |
A.v(SO2)=0.032 mol·L-1B.v(SO2)=0.050 mol·L-1
C.v(SO2)=0.050 mol·L-1·s-1D.v(SO2)=0.032 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、硫、氯元素在科研与生产中也有许多重要的用途。请回答下列问题:
(1)磷原子在成键时,能将一个3s电子激发进入3d能级而参加成键,写出该激发态原子的核外电子排布式________ 。
(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为___________。但NCl5不存在,其原因是___________________。
(3)N、P两种元素都能形成多种气态氢化物。联氨(N2H4)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离方程式_______________________。
(4)①请推测①HC1O4、②H5IO6[可写成(HO)5IO]、③HIO4三种物质的酸性由强到弱的顺序为_________(填序号)。
②已知一定条件下发生反应:Na2O+NaCl=Na3OCl,该反应过程中破坏和形成的化学键有_________。
(5)复杂磷酸盐有直链多磷酸盐(如图b)和环状偏磷酸盐(如图c)。其酸根阴离子都是由磷氧四面体(图a)通过共用氧原子连接而成。直链多磷酸盐的酸根离子(图b)中,磷原子和氧原子的原子个数比为n:____;含3个磷原子的环状偏磷酸盐的酸根离子(图c)的化学式为_____。

(6)多原子分子中各原子若在同一平面,且有互相平行的p轨道,则p电子可在多个原子间运动,形成离域π键。分子中的π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π,则SO2中的大π键应表示为___________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π,则SO2中的大π键应表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期VA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。
完成下列填空:
(1)砷原子核外有__个电子层,最外层有__个电子,写出砷原子最外层电子的轨道表示式:__。
(2)将砷与VA族所有短周期元素的原子半径,按从小到大的顺序排列:__(用元素符号表示)。
(3)溴位于VIIA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:__强于__(填物质的化学式)。
(4)周期表中,铝和砷都在金属和非金属过渡线附近,举一例说明铝元素具有非金属性:__。
(5)已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
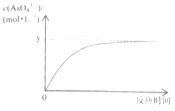
①写出该反应平衡常数的表达式K=___。
②不能判断反应达到平衡状态的是___(选填编号)。
A.溶液的pH不再变化
B.v(I-)=2v(AsO33-)
C.c(AsO33-)/c(I-)不再变化
D.c(I-)=2ymol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒的原子结构示意图为____________________________;
(2)![]() 的中心原子价层孤电子对数目为______,一个
的中心原子价层孤电子对数目为______,一个![]() 离子中含有_______个
离子中含有_______个![]() 键;
键;
(3)![]() 巯基烟酸氧钒配合物
巯基烟酸氧钒配合物![]() 图
图![]() 是副作用小的有效调节血糖的新型药物。
是副作用小的有效调节血糖的新型药物。
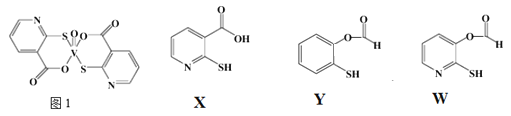
①该药物中N原子的杂化方式是_______;
②![]() 、Y、W三种物质在水中的溶解性由大到小的顺序为__________,原因是__________;
、Y、W三种物质在水中的溶解性由大到小的顺序为__________,原因是__________;
已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”
键”![]() 或大
或大![]() 键
键![]() 。大
。大![]() 键可用
键可用![]() 表示,其中m、n分别代表参与形成大
表示,其中m、n分别代表参与形成大![]() 键的原子个数和电子数,如苯分子中大
键的原子个数和电子数,如苯分子中大![]() 键表示为
键表示为![]() 。
。
③下列微粒中存在“离域![]() 键”的是_____;
键”的是_____;
![]()
![]()
![]()
![]()
④![]() 分子中大
分子中大![]() 键可以表示为_______________;
键可以表示为_______________;
(5)偏钒酸铵加热分解生成五氧化二钒、氨气、水。偏钒酸铵的阴离子呈如下图2所示的无限链状结构,则偏钒酸铵的化学式为_________;
(6)某六方硫钒化合物晶体的晶胞如图4所示![]()
![]() 表示V,
表示V,![]() 表示
表示![]() ,该晶胞的化学式为VS。图3为该晶胞的俯视图。
,该晶胞的化学式为VS。图3为该晶胞的俯视图。
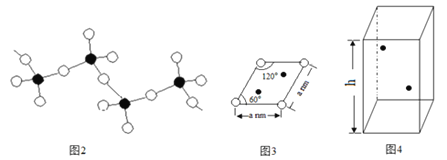
①请在图4中用![]() 标出V原子的位置;__________
标出V原子的位置;__________
②已知晶胞的密度为![]() ,计算晶胞参数
,计算晶胞参数![]() ____________cm。
____________cm。![]() 列出计算式即可
列出计算式即可![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作、现象得出相应结论一定正确的是
选项 | 实验操作、现象 | 实验结论 |
A | 用pH计测定同浓度NaF溶液和CH3COONa溶液: pH(NaF)<pH(CH3COONa) | 酸性:HF>CH3COOH |
B | 向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅 | c(KCl)增大使该反应 FeCl3+3KSCN 的化学平衡逆向移动 |
C | 向盛有2ml0.1mol·L-1AgNO3的试管中滴加5滴0.1mol·L-1NaCl溶液,出现白色沉淀;再往试管中滴加5滴0.1mol·L-1KI溶液,出现黄色沉淀 | KSP(AgCl)>KSP(AgI) |
D | 将10mL2mol/L FeCl3的溶液与1mL1mol/LKI溶液混合充分反应后滴加KSCN,溶液颜色变红 | KI与FeCl3反应有可逆性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有__________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_________。
(4
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式);呈两性的氢氧化物是_________(填物质化学式),该化合物与NaOH溶液反应的离子方程式为___________。
(6)用电子式表示元素③与⑨形成化合物的过程_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com