
分析 电解饱和食盐水时,阳极是氯离子失电子生成氯气的过程,阴极是氢离子得电子生成氢气的过程,氯元素化合价从-1价变化为0价,氢元素化合价从+1价变化为0价,生成氢氧化钠、氯气和氢气.
解答 解:电解饱和食盐水时,阳极是氯离子失电子生成氯气的过程,电极反应式为2Cl--2e-=Cl2↑,阴极是氢离子得电子生成氢气,电极方程式为2H++2e-=H2↑,氯碱工业的化学方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
点评 本题考查了电解反应化学方程式的书写,注意氯碱工业中用电解饱和食盐水的方法制取烧碱和氯气,阳极生成氯气,阴极生成氢氧化钠和氢气,题目难度不大.


科目:高中化学 来源: 题型:解答题
时间 浓度(mol?L-1) 温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>I2>Fe3+ | B. | Cl2>Fe3+>I2 | C. | Fe3+>Cl2>I2 | D. | Fe3+>I2>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- | |
| B. | 通入CO2气体的溶液中:Ca2+、I-、ClO-、NO3-、 | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:Na+、I-、SCN-、SO42- | |
| D. | 由水电离出的c(H+)=1.0×10-13 mol•L-1的溶液中:Na+、HCO3-、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )
我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )| A. | a 极是电源的正极,O2-在熔融盐中从右往左迁移 | |
| B. | 阳极电极反应式为2O2--4e-=O2↑ | |
| C. | 阳极每产生4.48L的O2,理论上能生成0.2mol钛 | |
| D. | NaCl-NaF融盐的作用是降低熔化TiO2需要的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
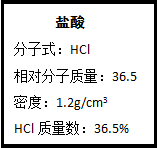 图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验步骤和操作 | 实验现象 |
| 实验一 | (I)取氧化亚铁固体[已部分变质,含有少量难溶于水的杂质Fe(OH)2Cl],向其中加入过量稀盐酸. (II)再加入稍过量的铁粉,振荡. | 固体完全溶解,溶液呈黄绿色 |
| 实验二 | (I)取实验一得到的溶液,加入KSCN溶液. (II)再加入少量H2O2溶液. | 无明显实验现象 溶液变红,有少量气泡 |
| 实验三 | (I)取10mL0.1mol/LKI溶液,滴加6滴0.1mol/L FeCl3溶液.(II)取少量上述黄色液体,滴加KSCN溶液. (III)另取上述黄色液体,加入淀粉溶液. | 溶液呈黄色 溶液变红 溶液变蓝 |
| 实验四 | (I)向实验三步骤I中所得的黄色溶液中加入2mLCCl4,充分振荡后,分离得到水层:重复操作三次. (II)向实验四步骤I中所得水层中加KSCN溶液. | 上层溶液无色 下层溶液为黄色 无明显实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ,B的结构式为
,B的结构式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 90% | B. | 80% | C. | 50% | D. | 40% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com