
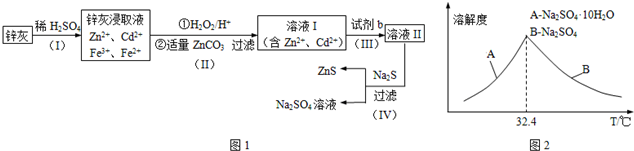
分析 锌灰与硫酸反应得含有镉离子、锌离子、铁离子、亚铁离子等的溶液,加入双氧水将二价铁离子氧化为三价铁离子,用碳酸锌调节平衡pH使Fe(OH)3完全沉淀,过滤后得到含有镉离子、锌离子的滤液Ⅰ,滤渣为Fe(OH)3、ZnCO3,步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为锌,过滤后得溶液Ⅱ为硫酸锌溶液,硫酸锌溶液中加入硫化钠可得硫酸钠和硫化锌,以此解答该题.
解答 解:(1)搅拌、适当升温、将废渣碾细成粉末、搅拌、多次浸取等都可提高锌灰的浸取率,故答案为:①②③⑤;
(2)根据上面的分析可知,步骤Ⅱ所得滤渣中的物质是Fe(OH)3、ZnCO3,
故答案为:Fe(OH)3、ZnCO3;
(3)根据上面的分析可知,试剂b应为锌,
故答案为:Zn(或锌);
(4)①ZnS固体是从硫酸钠溶液中析出的,所以检验ZnS固体是否洗涤干净的方法是取最后一次洗涤液少许于试管,滴加几滴BaCl2溶液,若出现浑浊则未洗净,反之则已洗净,
故答案为:取最后一次洗涤液少许于试管,滴加几滴BaCl2溶液,若出现浑浊则未洗净,反之则已洗净;
②等物质的量的Na2S04和CH4在高温、催化剂条件下生成Na2S,根据元素守恒可知,该化学反应方程式为Na2SO4+CH4$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$Na2S+2H2O+CO2,
故答案为:Na2SO4+CH4$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$Na2S+2H2O+CO2;
③根据溶解度随温度变化曲线可知,从滤液中得到Na2SO4.10H2O的操作方法是蒸发浓缩,降温结晶,过滤,
故答案为:蒸发浓缩,降温结晶,过滤;
(5)步骤Ⅲ所得Cd为d mol,则用于置换镉的锌的物质的量为d mol,硫酸钠的物质的量为VL×c mol/L=cVmol,所以硫酸锌的物质的量为cVmol,根据锌元素守恒可知,样品中锌元素的物质的量为cVmol-d mol-b mol,所以锌灰中含有锌元素的质量为65g/mol×(cVmol-d mol-b mol)=65(Vc-b-d)g,
故答案为:65(Vc-b-d)g.
点评 本题为工艺流程题,为高频考点和常见题型,难度较大,通过从废渣中制取硫化锌的工艺流程,考查了溶解平衡的移动、氧化还原方程式的书写、物质的分离等,熟悉物质的性质,清楚流程,是解题关键,侧重学生分析问题、解决问题能力的培养.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
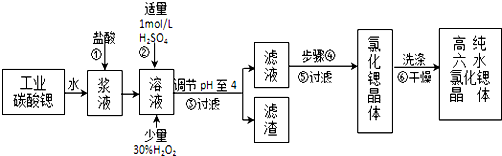
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐不能电离出阳离子 | B. | 盐不能电离出阴离子 | ||
| C. | 盐不能电离出H+或OH- | D. | 盐不能电离出共同的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与稀盐酸反应放出气体的快慢:Na2CO3>NaHCO3 | |
| B. | 配制成同物质的量浓度的溶液时,溶液的pH:Na2CO3>NaHCO3 | |
| C. | 106gNa2CO3和84gNaHCO3分别与过量的盐酸反应,放出CO2的质量:Na2CO3>NaHCO3 | |
| D. | 在Na2CO3和NaHCO3的稀溶液中,加CaCl2溶液都有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com