
【题目】氨基甲酸铵(![]() )是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
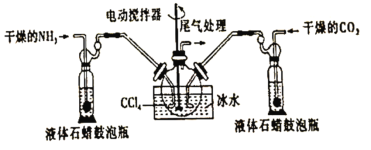
(1)制备氨基甲酸铵的化学方程式为____________
(2)三颈烧瓶用冰水冷却的原因是______________
(3)液体石蜡鼓泡瓶的作用是_______________
(4)水是很好的溶剂,且可以大量吸收反应混合气体,该反应中是否可用水作溶剂:________(填“是”或“否”),理由:___________
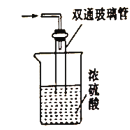
(5)尾气处理装置如图所示,双通玻璃管的作用是_________,浓硫酸的作用是________
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为1.00 g。则样品中氨基甲酸铵的质量分数为________
【答案】2NH3+CO2==NH2COONH4 降温,提高反应转化率(或降温,防止生成物分解) 观察气泡产生的速率,据此调节通入气体的比例 否 产物易水解 防止倒吸 吸收未反应的氨气,且避免水蒸气进入反应器中 80%
【解析】
把氨气和二氧化碳通入四氯化碳中,发生反应2NH3+CO2==NH2COONH4,由于反应放热,所以需将反应在低温下进行,以有利于提高反应物的转化率;从方程式中可以看出,参加反应的NH3与CO2的体积比为2:1,所以需设法控制气体的进入量;因为NH2COONH4易水解,所以两种反应物必须干燥,且吸收尾气的装置中也不能有水蒸气产生。计算样品中氨基甲酸铵的质量分数时,可先求出生成CaCO3的物质的量,再列方程,求出样品中所含NH2COONH4的物质的量,从而求出其质量及质量分数。据此回答题中各问。
(1)把氨气和二氧化碳通入四氯化碳中,可反应制得氨基甲酸铵,化学方程式为2NH3+CO2==NH2COONH4。答案为:2NH3+CO2==NH2COONH4;
(2)由于反应放热,所以需将反应在低温下进行,以有利于提高反应物的转化率,从而得出三颈烧瓶用冰水冷却的原因是降温,提高反应转化率(或降温,防止生成物分解)。答案为:降温,提高反应转化率(或降温,防止生成物分解);
(3)从方程式中可以看出,参加反应的NH3与CO2的体积比为2:1,所以需设法控制气体的进入量,由此得出液体石蜡鼓泡瓶的作用是观察气泡产生的速率,据此调节通入气体的比例。答案为:观察气泡产生的速率,据此调节通入气体的比例;
(4)由信息可知,NH2COONH4遇水易发生水解,所以该反应中不可用水作溶剂,理由:产物易水解。答案为:否;产物易水解;
(5)因为氨气极易溶于水,所以吸收尾气时,需注意防止倒吸,同时防止产生水蒸气进入反应容器,从而引起NH2COONH4的水解,所以双通玻璃管的作用是防止倒吸,浓硫酸的作用是吸收未反应的氨气,且避免水蒸气进入反应器中。答案为:防止倒吸;吸收未反应的氨气,且避免水蒸气进入反应器中;
(6)n(CaCO3)=![]() =0.01mol,设样品NH2COONH4的物质的量为x,则碳酸氢铵的物质的量为0.01-x,依题意可建立如下关系式:79(0.01-x)+78x=0.7820,从而求出x=0.08mol,则样品中氨基甲酸铵的质量分数为
=0.01mol,设样品NH2COONH4的物质的量为x,则碳酸氢铵的物质的量为0.01-x,依题意可建立如下关系式:79(0.01-x)+78x=0.7820,从而求出x=0.08mol,则样品中氨基甲酸铵的质量分数为![]() ≈80%。答案为:80%。
≈80%。答案为:80%。


科目:高中化学 来源: 题型:
【题目】铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
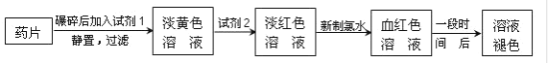
试回答下列问题:
(1)试剂1是__,试剂2是__,加入新制氯水后溶液中发生的离子反应方程式是__、_____。
(2)加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为__,写出+2价Fe在空气中转化为+3价Fe的化学方程式__。
(3)该同学猜想红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?__。若你认为合理,请说明理由(若你认为不合理,该空不作答);若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不作答)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:
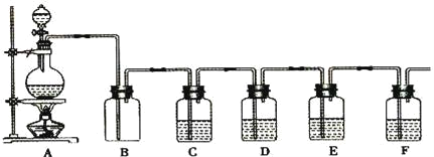
(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离过程为H2O ![]() H+ + OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14。则下列叙述正确的是
H+ + OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14。则下列叙述正确的是
A.c(H+)随温度的升高而降低
B.在35℃时,c(H+)>c(OH-)
C.25℃时水的电离程度大于35℃时水的电离程度
D.水的电离是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨与水性质相似,也存在微弱的电离:2NH3![]() NH4++NH2—,其离子积常数K=c(NH4+)·c(NH2—)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
NH4++NH2—,其离子积常数K=c(NH4+)·c(NH2—)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
A. 液氨的电离平衡 B. 液氨的离子积常数
C. c(NH4+) D. c(NH2—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO+4NH+2H2O
B.Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.水玻璃中通入少量的二氧化碳:Na2SiO3+CO2+H2O=2Na++CO32-+H2SiO3↓
D.少量SO2通入漂白粉溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出如下化学反应方程式或离子反应方程式:
(1)碳酸氢钠俗名________________,能够用来治疗胃酸过多,写出相关反应的离子方程式:______________________。
(2)漂白粉或漂粉精的有效成分为__________________,制取漂白粉的化学方程式为:___________,为防止漂白粉变质,应注意___________保存。
(3)在反应 3BrF3+5H2O = HBrO3+Br2+9HF+O2 中,被氧化![]() 元素是____________,当有5 mol水反应时,由H2O还原的BrF3为______________mol。
元素是____________,当有5 mol水反应时,由H2O还原的BrF3为______________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是________,D是________,G是________,H是________(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:_____________________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为__________________________。
(3)A中元素的原子结构示意图为________________。
(4)上述反应中属于氧化还原反应的是_________(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为氯及其化合物的“价-类”二维图。
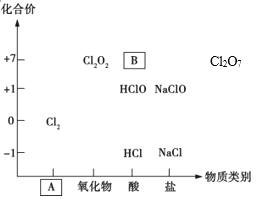
(1)填写二维图缺失的类别A_________和化学式B_________。
(2)某同学利用以下试剂研究HCl性质,进行了如下预测:
a.NaClO b.Fe c.NaOH d.KMnO4 e.AgNO3
从物质类别上看,HCl属于______,可能与__________发生反应(填序号);
从化合价角度看,Cl-具有______性,可能与_____发生反应(填序号)。
(3)某工厂用NaCl溶液制备氯气,其化学原理为如下反应:
![]() H2O +
H2O + ![]() NaCl == Cl2 +
NaCl == Cl2 + ![]() NaOH+
NaOH+![]()
①请将上述方程式补充完整,并用单线桥表示电子转移。_____________
②反应中NaCl作_________剂,理由是_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com