
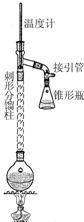
 乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下:
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下: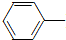 NH2+CH3COOH$\stackrel{△}{→}$
NH2+CH3COOH$\stackrel{△}{→}$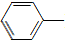 NHCOCH3+H2O
NHCOCH3+H2O| 物质 | 熔点 | 沸点 | 溶解度(20℃) |
| 乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
| 苯胺 | -6℃ | 184.4 | 3.4 |
| 醋酸 | 16.6℃ | 118℃ | 易溶 |
分析 (1)苯胺易被氧化,加入锌粉,防止苯胺被氧化,同时起着沸石的作用,防止暴沸;
(2)控制温度,防止未反应的乙酸蒸出,同时能除去反应生成的水;
(3)若让反应混合物冷却,会有固体析出;抽滤装置所包含的仪器除减压系统外还有:吸滤瓶、布氏漏斗;
(4)乙酰苯胺的溶解度受温度影响较大,且与乙酸、苯胺的溶解度相差较大,可以用重结晶的方法进行提纯.
解答 解:(1)苯胺易被氧化,加入锌粉,防止苯胺被氧化,同时起着沸石的作用,防止暴沸,
故答案为:防止苯胺被氧化,同时起着沸石的作用;
(2)温度过高,未反应的乙酸蒸出,降低反应物的利用率,温度过低,又不能除去反应生成的水,故选择控制温度计约105℃,
故答案为:温度过高,未反应的乙酸蒸出,降低反应物的利用率,温度过低,又不能除去反应生成的水;
控制温度,防止未反应的乙酸蒸出,同时能除去反应生成的水;
(3)若让反应混合物冷却,则固体析出沾在瓶壁上不易处理,故需要“趁热”过滤;抽滤装置所包含的仪器除减压系统外还有:吸滤瓶、布氏漏斗;
故答案为:若让反应混合物冷却,则固体析出沾在瓶壁上不易处理;吸滤瓶、布氏漏斗;
(4)乙酰苯胺的溶解度受温度影响较大,且与乙酸、苯胺的溶解度相差较大,可以用重结晶的方法进行提纯,故答案为:重结晶.
点评 本题考查有机物制备方案设计,涉及物质的分离提纯、对操作的分析评价、基本操作等,理解实验原理和物质的性质是解题的关键,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:填空题
| A组 | B组 | C组 | D组 |
| 金刚石:3550 | Li:181 | HF:-83 | NaCl:801 |
| 硅晶体:1410 | Na:98 | HCl:-115 | KCl:776 |
| 硼晶体:2300 | K:64 | HBr:-89 | RbCl:718 |
| 二氧化硅:1710 | Rb:39 | HI:-51 | CsCl:645 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氯乙烷中直接加入AgNO3溶液 | |
| B. | 加蒸馏水,然后加入AgNO3溶液 | |
| C. | 加入NaOH溶液,加热后酸化,然后加入AgNO3溶液 | |
| D. | 加入NaOH的乙醇溶液,然后加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 稳定性:HBr>HCl>HF | ||
| C. | 原子半径:r(Si)>r(N)>r(O) | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
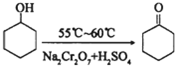
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3、20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
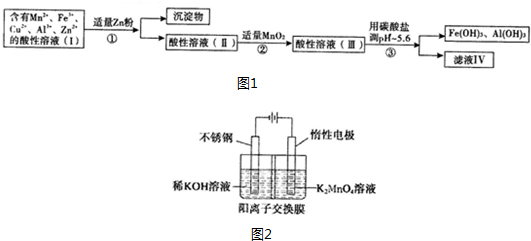
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| B. | 铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱 | |
| C. | 酸性H2CO3<H2SO4,判断硫与碳的非金属活动性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属与非金属化合时,都可以形成离子键 | |
| B. | 电负性相差越大的元素原子间越容易形成共价键 | |
| C. | 若元素原子核外电子数为a,则其核外共有a种不同运动状态的电子 | |
| D. | 同周期主族元素从左到右,第一电离能和电负性均依次增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com