
分析 (1)用次氯酸钠氧化氨,可以得到N2H4的稀溶液,次氯酸钠被还原生成NaCl,还有水生成;
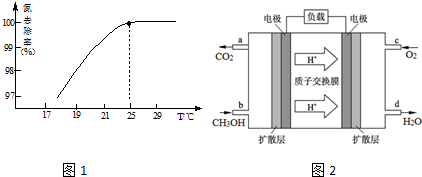
(2)①升高温度NH3的溶解度降低;
②氧化镁难溶于水中,不会形成二次污染;
(3)①根据电子转移守恒计算消耗氧气;
②甲醇和NO3-反应转化为两种无毒气体,应是生成N2、CO2,反应还生成水;
(4)原电池负极发生氧化反应,由示意图可知,甲醇在负极失去电子生成CO2与H+.
解答 解:(1)用次氯酸钠氧化氨,可以得到N2H4的稀溶液,次氯酸钠被还原生成NaCl,还有水生成,反应方程式为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(2)①在25℃前,升高温度氮去除率增大的原因是:因为氨气溶解度随温度升高,溶解度减小,有利于NH3的逸出,
故答案为:升高温度NH3的溶解度降低,有利于NH3的逸出;
②剩余的氧化镁,是难溶于水的物质,以沉淀的形式排出,不会形成二次污染,
故答案为:氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染;
(3)①14g铵态氮元素物质的量为$\frac{14g}{14g/mol}$=1mol,根据电子转移守恒,转化为硝态氮元素时需氧的物质的量为$\frac{1mol×[5-(-3)]}{4}$=2mol,需要氧气质量为2mol×32g/mol=64g,
故答案为:64g;
②甲醇和NO3-反应转化为两种无毒气体,应是生成N2、CO2,反应还生成水,反应离子方程式为:6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O,
故答案为:6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O;
(4)原电池负极发生氧化反应,由示意图可知,甲醇在负极失去电子生成CO2与H+,负极电极反应式为:CH3OH+H2O-6e-=CO2↑+6H+,
故答案为:CH3OH+H2O-6e-=CO2↑+6H+.
点评 本题比较综合,涉及反应热计算、电极反应式书写、氧化还原反应计算等,是对学生综合能力考查,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
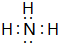 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
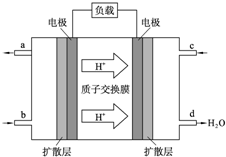 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m1>m2 | B. | m1<m2 | C. | m1≥m2 | D. | m1≤m2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一周期第ⅠA族 | B. | 第二周期第VⅡA族 | C. | 第三周期第VⅡA族 | D. | 第三周期第ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com