
| 熔点/℃ | 沸点/℃ | 燃烧热/kJ•mol-1 | |
| 铝 | 660 | 2467 | 602 |
| 氧化铝 | 2050 | 2980 | / |
分析 (1)根据铝燃烧发热书写热化学反应方程式;
(2)①该原电池中,铝易失电子作负极,铜作正极,电子从铝沿导线流向铜,电流计指针偏向失电子的电极;
②在浓硝酸中,铝被钝化,铜溶解,所以铜易失电子为负极,铝是正极,电流计指针偏向失电子的电极;
(3)工业上用电解氧化铝的方法制取铝,要消耗大量的电能,不能缓解能源紧张.
解答 解:(1)铝燃烧发热,并且铝的燃烧热为602kJ•mol-1,所以导致铝片发烫的热化学反应方程式为:4Al(s)+3O2(g)=2Al2O3(s),△H=-2408KJ/mol,故答案为:4Al(s)+3O2(g)=2Al2O3(s),△H=-2408KJ/mol;
(2)①该原电池中,铝易失电子作负极,铜作正极,负极上铝失电子发生氧化反应,电极反应式为:Al-3e-=Al3+,电流计指针偏向失电子的电极,所以电流计指针偏向铝,
故答案为:铝;Al-3e-=Al3+;
②该原电池中,铝和浓硝酸发生钝化现象而阻止进一步反应,铜易和浓硝酸反应,所以铜易失电子而作负极,铝作正极,电流计指针偏向失电子的电极铜,铜电极上失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,正极上硝酸根离子得电子生成二氧化氮,电极反应式为:2NO3-+2e-+4H+=2NO2↑+2H2O,
故答案为:铜;正,2NO3-+2e-+4H+=2NO2↑+2H2O;
(3)工业上用电解氧化铝的方法制取铝,要消耗大量的电能,不能缓解能源紧张;铝作为民用新型能源,不可行.
故答案为:B;工业上用电解氧化铝的方法制取铝,要消耗大量的电能.
点评 考查铝及化合物性质,比较基础,注意基础知识掌握,(3)中对方案、设想进行评价,是一道开放性问题、社会性问题,是对学生综合能力考查.


科目:高中化学 来源: 题型:解答题
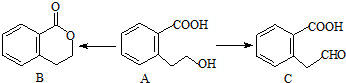
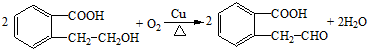 .
.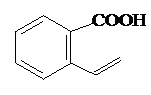 或
或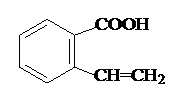 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlO2-、SO42-、Cl-、K+ | B. | Al3+、Ca2+、HCO3-、Na+ | ||
| C. | Fe3+、NH4+、SO42-、SCN- | D. | H+、Cl-、Na+、HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH |  | 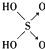 | 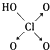 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
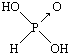 和
和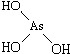 ,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性
,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④⑥ | C. | ①②④⑥ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷的分子式是C3H6 | |
| B. | 丙烷分子中的碳原子在一条直线上 | |
| C. | 丙烷在光照条件下能够发生取代反应 | |
| D. | 丙烷的熔点比乙烷低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

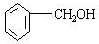 ;
; ;
;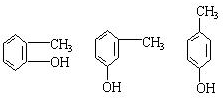
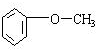 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com