
| A. | 氯原子 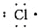 | B. | 氟原子 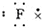 | C. | 溴化钡 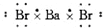 | D. | 硫化钾 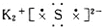 |
分析 A.氯原子最外层7个电子;
B.氟原子最外层7个电子;
C.溴化钡为离子化合物,钡离子与两个溴离子通过离子键结合;
D.硫化钾为离子化合物,2个钾离子与硫离子通过离子键结合,注意钾离子不能合写.
解答 解:A.氯原子最外层7个电子,电子式为: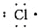 ,故A正确;
,故A正确;
B.氟原子最外层7个电子,电子式: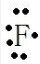 ,故B错误;
,故B错误;
C.溴化钡为离子化合物,电子式为: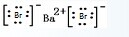 ,故C错误;
,故C错误;
D.硫化钾为离子化合物,钾离子不能合并,电子式为: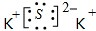 ,故D错误;
,故D错误;
故选:A.
点评 本题考查电子式的书写,注意电子式书写注意事项:简单阳离子的电子式为其离子符合,复杂的阳离子电子式除应标出共用电子对、非共用电子对等外,还应加中括号,并在括号的右上方标出离子所带的电荷.无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 | |
| B. | 滴定结束后,滴定管尖嘴处有一悬挂液滴 | |
| C. | 取NaOH溶液时先平视读数,后仰视读数 | |
| D. | 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2次~3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
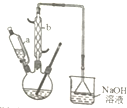 己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:
己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO+H2$\stackrel{Ni}{→}$CH3CH2OH | |
| B. | CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O | |
| C. | CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O | |
| D. | 2CH3CHO+O2$\stackrel{△}{→}$2CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 | |
| B. | 检验溶液中是否含有NH4+:取少量待检验溶液,向其中加入浓NaOH溶液加热,再用湿润的红色石蕊试纸放置试管口,观察现象 | |
| C. | 提纯含有少量苯酚的苯:向含有少量苯酚的苯加入过量浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 | |
| D. | 浸有KMnO4(H+)溶液的滤纸中滴加SO2水溶液,滤纸褪色,说明SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高正价依次升高 | |
| B. | 气态氢化物稳定性逐渐增强 | |
| C. | 原子半径逐渐增大 | |
| D. | 最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com