
【题目】根据电子排布三原理,填写下列空白。
(1)基态Mn2+的核外电子排布式为________。
(2)磷原子外围电子排布式为________。
(3)氧元素基态原子核外未成对电子数为________个。
【答案】1s22s22p63s23p63d5(或[Ar]3d5) 3s23p3 2
【解析】
(1)Mn元素的原子核外有25个电子,其基态原子电子排布式为1s22s22p63s23p63d54s2;
(2)磷原子核电荷数为15,为第ⅤA族元素;
(3)由泡利原理可知,基态氧原子的轨道表示式为![]() ,再判断未成对电子数。
,再判断未成对电子数。
(1)Mn元素的原子核外有25个电子,其基态原子电子排布式为1s22s22p63s23p63d54s2,则基态Mn2+的核外电子排布式为1s22s22p63s23p63d5(或[Ar]3d5);
(2)磷原子核电荷数为15,为第ⅤA族元素,则外围电子排布式为3s23p3;
(3)由泡利原理可知,基态氧原子的轨道表示式为![]() ,则基态氧原子核外未成对电子数为2个。
,则基态氧原子核外未成对电子数为2个。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是

A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2
B.③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
C.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
D.由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组同学根据影响化学反应速率的因素进行实验验证,其设计的实验方案如下:请你帮他们把表填写完整,并做出评价。
(1)甲同学验证还原性:I->Br-
实验步骤 | 实验现象 | 实验结论及离子反应式 |
| 逐滴加入的同时振荡,观察CCl4层的颜色: 甲___ 乙___; 乙中CCl4层颜色明显变化的快。 | 离子方程式: 甲__ 乙__ 结论:验证成立,还原性,I->Br- |
(评价)甲同学设计的实验方案是__(填“合理”或“不合理”),理由是__。
(3)乙同学验证固体反应物的颗粒大小的对反应速率影响
实验步骤:在试管①中加入1g粉末状大理石,加入4mol/L盐酸20mL(过量);在试管②中加入2g颗粒状大理石,加入4mol/L盐酸20mL(过量)。他根据实验过程,绘制出的生成CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图,你认为__是符合的。
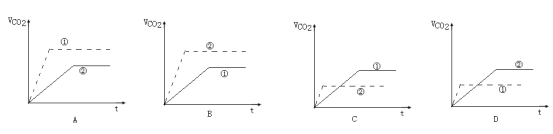
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在化学工业有着广泛的应用,
(1)工业冶炼铝的化学方程式是______;
(2)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换法膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
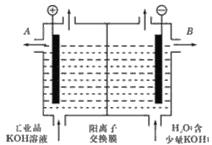
①该电解槽的阳极反应式是________;
②除去杂质后的氢氧化钾溶液从液体出口_______(填写“A”或“B”)导出。
(3)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠。
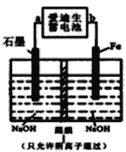
①此装置中爱迪生蓄电池的负极是________(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是______。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)已知H2O2的结构如图:
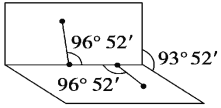
H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′。根据该结构写出H2O2分子的电子式______。估计它难溶于CS2,简要说明原因:________________。
(2)O、S、Se原子的第一电离能由大到小的顺序为____________________。
(3)H2Se的酸性比H2S_____(填“强”或“弱”)。气态SeO3分子的立体构型为______,SeO32-离子中Se的杂化方式为______。
(4)硒化锌的晶胞结构如图所示,硒离子的配位数是____,若晶胞参数为d pm,则硒化锌的密度为______ g·cm-3。(不需要化简,1 m=109 nm=1012 pm)。
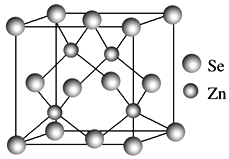
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是____。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_____ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE( )。
)。
①CH3CN中碳原子的杂化方式是 ____ 和_____ 。
②TCNE中第一电离能较大的是 ___(填元素符号),分子中所有原子____(填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是 ___。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:
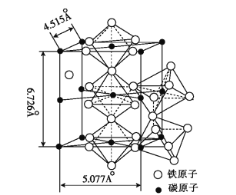
Fe3C的密度为 ___(列出计算式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用NOx+NH3![]() N2+H2O,使NOx转化为无毒的N2,现有NO、NO2的混合气体3.0 L,可与3.5 L相同状况的NH3恰好完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是()
N2+H2O,使NOx转化为无毒的N2,现有NO、NO2的混合气体3.0 L,可与3.5 L相同状况的NH3恰好完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是()
A.1∶3B.2∶1
C.3∶1D.1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通锌锰电池筒内无机物主要成分为MnO2、NH4Cl、ZnCl2等。某研究小组探究废于电池内的黑色固体并回收利用时,进行如图所示实验。下列有关实验的叙述正确的是
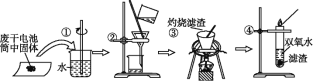
A. 操作①中玻璃棒的作用是转移固体 B. 操作②为过滤,得到的滤液显碱性
C. 操作③中盛放药品的仪器是坩埚 D. 操作④的目的是除去滤渣中的杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如下:
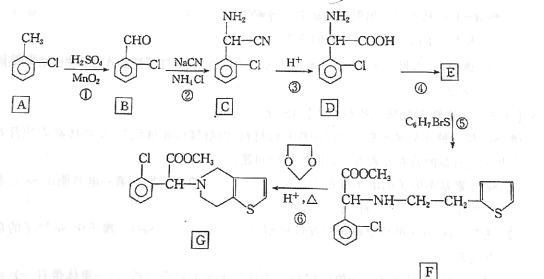
回答下列问题:
(1)B的名称为____;D中含有的无氧官能团结构简式为____。
(2)反应④的反应类型为____;反应⑥生成G和X两种有机物,其中X的结构简为_____。
(3)反应⑤的化学反应方程式为_____(C6H7BrS用结构简式表示)。
(4)满足下列条件的C的同分异构体共有 ___种,写出其中一种有机物的结构简式:____。
①苯环上连有碳碳三键;②核磁共振氢谱共有三组波峰。
(5)请设计由苯甲醇制备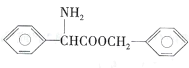 的合成路线(无机试剂任选)____:
的合成路线(无机试剂任选)____:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com