
| A. | 碳酸的电离子方程式:H2CO3═2H++CO32- | |
| B. | 过量铁粉与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 次氯酸钠溶液中滴入浓盐酸产生Cl2:2H++Cl-+ClO-═Cl2↑+H2O | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液并加热:NH4++Fe2++3OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Fe(OH)2↓+H2O |
分析 A.碳酸为弱酸,电离方程式分步书写,主要写出第一步的电离即可,且应该使用可逆号;
B.铁粉过量,反应生成亚铁离子;
C.书写条件下氯离子与次氯酸根离子反应生成氯气;
D.氢氧化钠过量,铵根离子完全反应,铵根离子与亚铁离子的物质的量之比为2:1.
解答 解:A.碳酸的电离方程式需要分步书写,写出第一步的电离即可,正确的电离方程式为:H2CO3?H++HCO3-,故A错误;
B.过量铁粉与稀硝酸反应生成硝酸亚铁、NO气体和水,正确的离子方程式为:3Fe+8H++2NO3-═Fe2++2NO↑+4H2O,故B错误;
C.次氯酸钠溶液中滴入浓盐酸产生Cl2,反应的离子方程式为:2H++Cl-+ClO-═Cl2↑+H2O,故C正确;
D.(NH4)2Fe(SO4)2溶液中加入过量NaOH溶液并加热,正确的离子方程式为:2NH4++Fe2++4OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+Fe(OH)2↓+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 硝酸型酸雨的形成:3NO2+H2O═2HNO3+NO | |
| B. | 用Fe2(SO4)3做净水剂:Fe3++3H2O?Fe(OH)3+3H+ | |
| C. | 水垢中的CaSO4用Na2CO3溶液处理:Ca2++CO32-═CaCO3↓ | |
| D. | 向5 mL 0.1mol•L-1的K2Cr2O7溶液中滴加5滴浓硫酸,溶液橙色变深:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个Fe(OH)3胶体粒子的质量为107g | |
| B. | 标准状况下,1L液态水中含有的H+数目为10-7NA | |
| C. | 14g分子式为CnH2n的链烃中含有的碳碳双键的数目为NA/n | |
| D. | 1 mol冰醋酸和l mo1乙醇经酯化反应可生成H2O分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
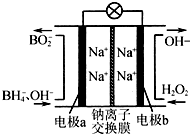 硼氢化钠(NaBH4)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图.下列说法正确的是( )
硼氢化钠(NaBH4)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图.下列说法正确的是( )| A. | 电极a为正极,b为负极 | |
| B. | 放电时,Na+从b极区移向a极区 | |
| C. | 电极b上发生的电极反应为H2O2+2e-═2OH- | |
| D. | 每生成1 mol BO2-转移6 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
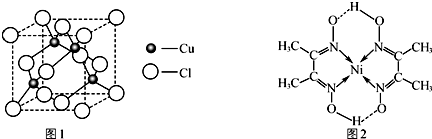
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
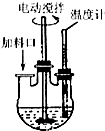 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.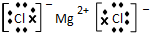 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加硝酸酸化,再加氯化钡溶液 | B. | 先加硝酸酸化,再加硝酸钡溶液 | ||
| C. | 先加盐酸酸化,再加氯化钡溶液 | D. | 先加盐酸酸化,再加硝酸铜溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com