



科目:高中化学 来源: 题型:
| A、苯不能使酸性KMnO4溶液褪色 |
| B、苯在一定条件下可与液溴发生取代反应 |
| C、苯在一定条件下可与H2发生加成反应 |
| D、苯不能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
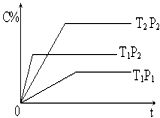 已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ?mol-1,在密闭容器中进行,如图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ?mol-1,在密闭容器中进行,如图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是( )| A、T1<T2 P1>P2 m+n<P Q<0 |
| B、T1>T2 P1<P2 m+n>P Q>0 |
| C、T1<T2 P1<P2 m+n<P Q>0 |
| D、T1>T2 P1<P2 m+n>P Q<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COOH溶液和Na2CO3溶液与CH3COOH溶液和NaHCO3溶液 |
| B、CaCO3和HCl溶液与Na2CO3和HCl溶液 |
| C、BaCl2溶液和Na2SO4溶液与Ba(OH)2溶液与H2SO4溶液 |
| D、KOH溶液和CH3COONH4溶液与Ba(OH)2溶液与NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 | OH-、Cl-、HCO3-、NO3-、SO42- |
| AgNO3溶液 |
| 稀HNO3 |
| AgNO3溶液 |
| 稀HNO3 |
| 实验步骤 | 预期现象和结论 |
| 取适量C的溶液于试管中,① | 预期现象和结论1:② 预期现象和结论2:③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L H2O含有的电子数等于NA |
| B、常温下,100mL 1mol?L-1 Na2CO3溶液中阴离子总数大于0.1NA |
| C、分子数为NA的N2、C2H4混合气体体积约为22.4L,质量为28g |
| D、3.4g NH3中含N-H键数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com