
在298 K、100 kPa时,已知:
2H2O(g)===2H2(g)+O2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是 ( )。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
下列与有机物的结构、性质有关的叙述正确的是
A.苯、油脂均不能使酸性KMnO4溶液褪色
B. 煤的干馏和石油的分馏均属化学变化
C.乙醇可以被氧化为乙酸,二者都能发生取代反应
D.淀粉和蛋白质均可作为生产葡萄糖的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是( )
A.①③②④ B.①③④②
C.③④②① D.③①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是 ( )。
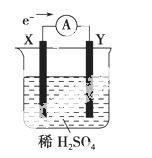
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为铁和碳棒,则X为碳棒,Y为铁
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(1)写出铜溶解于上述混合液的离子方 程式_______________________________________________。
程式_______________________________________________。
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是________g,溶液中的c(SO42-)=________mol·L-1。
(3)若欲在如图所示的装置中发生反应,请判断图中的正、负极,并选出适当的物质作电极,写出电极反应式,填在相应的表格中。
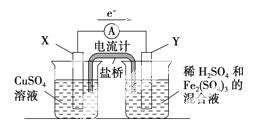
| 正、负极判断 | 电极材料 | 电极反应式 | |
| X极 | |||
| Y极 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分解1mol H2O2放出热量98KJ。在含有少量I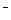 的溶液中,H2O2分解的机理为:
的溶液中,H2O2分解的机理为:
H2O2+ I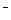
 H2O+IO
H2O+IO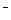
H2O2+ IO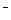
 H2O+O2+ I
H2O+O2+ I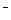
下列有关该反应的说法正确的是( )
A.反应速率与I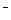 浓度有关 B.IO
浓度有关 B.IO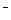 也是该反应的催化剂
也是该反应的催化剂
C.反应活化能等于98KJ mol-1 D.
mol-1 D.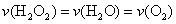
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、H Br、HI的酸性
Br、HI的酸性
(3)工业上, 通过如下转化可制得KClO3晶体:
通过如下转化可制得KClO3晶体:
NaCl溶液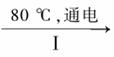 NaClO3溶液
NaClO3溶液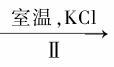 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②II中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因 是 。
是 。
(4)一定条件,在水溶液中1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。

①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了合理 利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得:5 g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5 kJ的热量 。试写出甲醇燃烧的热化学方程式:_______________________________________________________。
。试写出甲醇燃烧的热化学方程式:_______________________________________________________。
(2)由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形 成过程。在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
成过程。在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
| 化学键 | H—H | N—H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2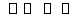 2NH3 ΔH=a kJ·mol-1。
2NH3 ΔH=a kJ·mol-1。
试根据表中所列键能数据计算a的数值(列出简单的计算式):________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)===CO2(g)
ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l)
ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH3=-2 599 kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的焓变(列出简单的计算式):
__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N(部分产物及反应条件已略去)。
(1)生成M、N的反应类型分别是 、 ; D的结构简式是 。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种。C的结构简式是 。
(3)由苯酚生成A的化学方程式是 。
B与C反应的化学方程式是 。
(4)以苯酚为基础原料也可以合成芳香族化合物F。经质谱分析F的相对分子质量为152,其中氧元素的质量分数为31.6%,F完全燃烧只生成CO2和H2O。则F的分子式是 。
已知:①芳香族化合物F能发生银镜反应,且还能发生水解反应;
②F的核磁共振氢谱显示其分子中含有4种氢原子;
③分子结构中不存在“-O-O- ”的连接方式。F的结构简式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com