
【题目】在某水溶液样品中滴加氯化钡溶液,产生白色沉淀;再滴加盐酸,沉淀部分消失,并有无色无味的气体产生.由此判断该溶液中肯定不存在的离子是( )
A.Ag+B.SO42﹣C.CO32﹣D.NH4+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在通电条件下,用如图所示装置由乙二醛(OHC-CHO)制备乙二酸(HOOC-COOH),其制备反应为OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl,下列说法不正确的是

A. 盐酸是起提供Cl-和增强导电性的作用
B. Pt1的电极反应为2H++2e-=H2↓
C. 每得到1mol乙二酸将有2mol H+从右室迁移到左室
D. 每消粍0.1mol乙二醛在Pt1极放出4.48气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F ( )是合成某种药物的中间体,它的一种合成路线如图所示:
)是合成某种药物的中间体,它的一种合成路线如图所示:

回答下列问题:
(1)A的结构简式为_________________。
(2)检验B中官能团的实验操作是____。
(3)D中官能团的名称是_______,①-④中属于加成反应的是________________(填序号)。
(4)反应③的化学方程式为_________。
(5)反应⑤的生成物有两种,除了 F以外,另一种产物为____________________________。
(6)满足下列条件的D的同分异构体有__________种。(不考虑立体异构)
①能与FeCl3溶液发生显色反应;②能发生银镜反应;③分子中有1个乙基。
(7)请仿照E的合成路线,设计由![]() 合成
合成![]() 的路线:
的路线:
___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈是地壳中含量最高的稀土元素,二氧化铈(CeO2)是其重要的化合物。平板液晶显示屏生产过程中产生大量的废玻璃粉末,其中含CeO2、SiO2、Fe2O3等物质,某实验小组以此粉末为原料回收铈,设计流程如图所示:
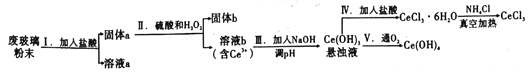
(1)步骤Ⅰ加入过量盐酸后,溶液a中的阳有离子___________________。
(2)步骤Ⅱ中反应的氧化剂和还原剂的物质的量之为___________。
(3)为了使步骤Ⅲ所得悬浊液中的Ce3+浓度为1×10-6mol·L-1,则加入NaOH调节溶液的pH应为____________[已知:Ce(OH)3的Ksp=8.0×10-21,lg2=0.3]。
(4)将NH4Cl固体与CeCl3·6H2O混合真空加热可得无水CeCl3,其中加入NH4Cl的作用是__________。
(5)第Ⅴ步反应的化学方程式是____________________;用反应得到的悬浊液制备纯净的Ce(OH)4需进行的实验操作为______________。
(6)对CeCl3样品纯度进行测定的方法:准确称取样品wg配成100mL溶液,取25.00mL置于锥形瓶中,加入稍过量的过二硫酸铵[(NH4)2S2O8]溶液将Ce3+氧化为Ce4+,然后用萃取剂[用(HT2)表示]萃取Ce4+,再用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(其离子反应方程式为Ce4++Fe2+=Ce3++Fe3+),重复2~3次,平均消耗VmL标准溶液。
①“萃取”时存在反应:Ce4++n(HT)2![]() Ce(H2n-4)+4H+,若要提高滴定的准确率,应使溶液呈______性(填“酸”“中”或“碱”)。
Ce(H2n-4)+4H+,若要提高滴定的准确率,应使溶液呈______性(填“酸”“中”或“碱”)。
②经计算,CeCl3样品的纯度为________________。 [M(CeCl3)=246.5g·mol-1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列化学仪器:①托盘天平;②玻璃棒;③药匙;④烧杯;⑤量筒;⑥容量瓶;⑦胶头滴管;⑧细口试剂瓶;⑨标签纸.
(1)现需要配制450mL 1molL﹣1硫酸溶液,需用质量分数为98%、密度为1.84gcm﹣3的浓硫酸mL.需用mL 容量瓶.
(2)从上述仪器中,按实验使用的先后顺序,其编号排列是 .
(3)定容:继续向容量瓶中加蒸馏水至液面距刻度线1~2cm,改用小心滴加蒸馏水至溶液凹液面底部与刻度线相切.如果不小心加多, 应该
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”). ①用以稀释硫酸的烧杯未洗涤, .
②未经冷却趁热将溶液注入容量瓶中, .
③定容时观察液面俯视, .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.X、Y、Z、W是中学化学中常见的四种气体。己知:X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收;X是化石然料燃烧的产物之一,是形成酸雨的物质;Y是一种单质,它的水溶液其有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,能与水反应;W气体的水溶液滴入酚酞变红色。
请回答下列问题:
(1)X、Y两种气体按物质的量之比1:1在水溶液中能发生反应,化学方程式为_______;
(2)科学家发现,Z在催化剂条件下能与W反应,反应产物中有单质生成,该单质应是(填化学式)____________;该反应是氧化还原反应,则其中的氧化剂是(填化学式)_______。
(3)在Z与水的反应中,氧化剂与还原剂的物质的量之比为________。
(4)检验W气体的方法是_____________。
II.H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,其中生物脱H2S的原理为:
H2S+Fe2(SO4)3=S+2FeSO4+H2SO4
4FeSO4+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
回答下列方法中的问题。
(l)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是_______。
(2)由图1和图2判断使用硫杆菌的最佳条件为______。若反应温度过高,反应速率下降,其原因是______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com