
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-396 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-896 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)=2H2O(l)△H=-286 kJ•mol-1 | |
| D. | CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=+736kJ•mol-1 |
分析 煤炭、氢气、天然气和甲醇(CH3OH)的热值(指一定条件下单位质量的物质完全燃烧所放出的热量)依次是33kJ•g-1、143kJ•g-1、56kJ•g-1、23kJ•g-1,分别根据m=nM计算出1mol煤炭、氢气、天然气和甲醇(CH3OH)放出的热量,然后根据燃料的热值以及热化学方程式的含义进行计算,
解答 解:A、煤炭的热值是33kJ•g-1,则12g煤炭放出的热量为396kJ,所以热化学方程式为:C(s)+O2(g)=CO2(g)△H=-396kJ•mol-1,故A错误;
B、天然气的热值是56kJ•g-1,则16gCH4放出的热量为896kJ,所以热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-896kJ•mol-1,故B正确;
C、氢气的热值是143kJ•g-1,则4gH2放出的热量为572kJ,所以热化学方程式:2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1,故C错误;
D、甲醇(CH3OH)的热值是23kJ•g-1,则32gCH3OH防出的热量为736kJ,所以热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-736kJ•mol-1,故D错误;
故选B.
点评 本题主要考查了热化学方程式的书写以及反应热的计算,题目难度中等,要能根据热值来计算一定量的物质燃烧时放出的热量,试题培养了学生的分析能力及化学计算能力.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:选择题
| A. | 蔗糖加稀硫酸水解后,加入新制氢氧化铜溶液,煮沸,可以检验产物是否含有葡萄糖 | |
| B. | 钠可保存在煤油中,而钠可与乙醇发生反应,可说明乙醇分子含有羟基的氢原子 | |
| C. | 可用溴水鉴别乙醇、己烷、硝基苯、乙酸 | |
| D. | 乙酸乙酯和乙醇可用分液的方式分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电解法精炼铜时,粗铜做阴极 | |
| B. | 电解稀硫酸制O2、H2时,铜做阳极 | |
| C. | 在镀件上电镀铜时,可用金属铜做阳极 | |
| D. | 在电解池中,铜做阳极时,溶液中的阴离子在铜极上失电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
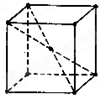 某晶体为体心立方晶格(如图),实验测得其密度为ρ(g•cm-3).已知它的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定晶体中原子为等径的刚性球且处于体对角性上的三个球相切.则该晶体晶胞的边长(cm)为( )
某晶体为体心立方晶格(如图),实验测得其密度为ρ(g•cm-3).已知它的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定晶体中原子为等径的刚性球且处于体对角性上的三个球相切.则该晶体晶胞的边长(cm)为( )| A. | $\root{3}{\frac{2a}{{N}_{AP}}}$ | B. | $\sqrt{3}$•$\root{3}{\frac{2a}{{N}_{AP}}}$ | C. | $\frac{\sqrt{3}}{4}$×3$\sqrt{\frac{2a}{{N}_{AP}}}$•3 | D. | $\frac{1}{2}$•3$\sqrt{\frac{2a}{{N}_{AP}}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | A的物质的量浓度 | D. | 反应速度:VB(正)=VC(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 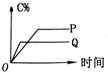 | B. | 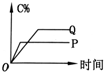 | C. | 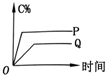 | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com